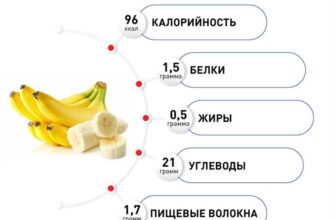
Виды дистанционной лучевой терапии
Эффективность радионуклидной лучевой терапии и брахитерапии зависит от точности расчета дозы и соблюдения технологического процесса, а приемы реализации этих методов не демонстрируют большого разнообразия. Но дистанционная лучевая терапия имеет массу подвидов, каждый из которых характеризуется своими особенностями проведения и показаниями для применения.
Высокая доза подводится единоразово, либо короткой серией фракций. Может проводиться на Гамма-Ноже или КиберНоже, а также на некоторых линейных ускорителях.

Один из примеров плана радиохирургии на КиберНоже. Множество тонких пучков (бирюзовые лучи в левой верхней части), пересекаясь в области расположения опухоли позвоночника, формируют зону высокой дозы ионизирующего излучения (зона внутри красного контура), которая складывается из дозы каждого отдельного луча.
Наибольшее распространение радиохирургия получила в лечении опухолей головного мозга и позвоночника (в том числе доброкачественных), являясь бескровной альтернативой традиционному хирургическому лечению на ранних стадиях. Успешно применяется и для лечения четко локализованных опухолей (рак почки, рак печени, рак легкого, увеальная меланома) и ряда неонкологических заболеваний, таких как сосудистые патологии (АВМ, каверномы), невралгии тройничного нерва, эпилепсии, болезни Паркинсона и др.).
- лучевая терапия на линейном ускорителе
Обычно, 23-30 сеансов лечения фотонами для опухолей внутри тела, либо электронами для поверхностных опухолей (например, базалиома).

Пример плана лучевой терапии при лечении рака простаты на современном линейном ускорителе (используется метод VMAT: RapidArc®). Высокая доза излучения, губительная для опухолевых клеток (зона, окрашенная в красные и желтые оттенки) складывается в зоне пересечения полей различной формы, поданных из различных положений. При этом здоровые ткани, которые окружают опухоль либо через которые проходит каждое из полей, получают толерантную дозу, не вызывающую необратимых биологических изменений.
Линейный ускоритель — важный компонент в составе сочетанного лечения опухолей любой стадии и любой локализации. Современные линейные ускорители, помимо возможностей модификации формы каждого из полей излучения для максимальной защиты здоровых тканей от радиации, могут агрегироваться с томографами для еще большей точности и скорости лечения.
- лучевая терапия на радиоизотопных аппаратах
Ввиду низкой точности эта разновидность лечения, практически не применяется в мире, а рассматривается по причине того, что значительная часть лучевой терапии в государственной онкологии России все еще проводится на таком оборудовании. Единственный из методов, не предлагаемый в МИБС.

Привет из 70-х — гамма-терапевтический аппарат “Рокус”. Это — не музейный экспонат, а оборудование, на котором проходят лечение пациенты одного из государственных онкоцентров
Наиболее эффективный, точный и безопасный вид воздействия на опухоль элементарными частицами протонами. Особенность протонов — высвобождение максимальной энергии на конкретном контролируемом участке траектории полета, что в разы снижает лучевую нагрузку на организм, даже в сравнении с современными линейными ускорителями.

Слева — прохождение поля фотонов при лечении на линейном ускорителе, справа — прохождение протонного пучка при протонной терапии.
Красная зона — зона максимальной дозы излучения, синяя и зеленые — зоны умеренного облучения.
Уникальность свойств протонной терапии делает этот метод лечения одним из наиболее эффективных в лечении опухолей у детей.
Виды лучевой терапии
Традиционно в радиотерапии выделяют три способа воздействия ионизирующего излучения на опухоль:
Наивысшего технического уровня достигло лучевое лечение, при котором доза излучения доставляется бесконтактно, с небольшого расстояния. Дистанционная лучевая терапия проводится как с использованием ионизирующего излучения радиоактивных радиоизотопов (современная медицина использует дистанционное излучение изотопов только при радиохирургии на Гамма-Ноже, хотя в некоторых онкоцентрах России все еще можно встретить старые аппараты для радиотерапии работающие на изотопе кобальта), так и с применением более точных и безопасных ускорителей элементарных частиц (линейный ускоритель или синхроциклотрон при протонной терапии).


Так выглядят современные аппараты для дистанционного лучевого лечения опухолей (слева направо, сверху вниз): Линейный ускоритель, Гамма-нож, КиберНож, Протонная терапия
Брахитерапия — воздействие источников ионизирующего излучения (изотопов радия, йода, цезия, кобальта и др.) на поверхность опухоли, либо их вживление в объем новообразования.

Одно из “зерен” с радиоактивным материалом, вживляемых в опухоль при брахитерапии
Наиболее популярно применение брахитерапии для лечения опухолей, к которым имеется относительно простой доступ: рак шейки и тела матки, рак языка, рак пищевода и т.д.
Радионуклидная лучевая терапия подразумевает собой введение микрочастиц радиоактивного вещества, накапливаемых тем или иным органом. Наибольшее развитие получила радиойодтерапия при которой вводимый радиоактивный йод накапливается в тканях щитовидной железы, разрушая опухоль и ее метастазы высокой (абляционной) дозой.
Некоторые из выделяемых в отдельные группы видов лучевого лечения, как правило, имеют в своей основе один из трех указанных выше способов. Например, интраоперационная лучевая терапия (ИОЛТ), проводимая на ложе удаленной опухоли во время хирургического вмешательства — это обычная лучевая терапия на линейном ускорителе меньшей мощности.
Витамины и онкология
В статье проводится обзор клинических исследований, посвящённых применению витаминных препаратов у онкологических больных, а также рассматривается их профилактическое влияние на развитие опухолевых заболеваний.
Не безызвестно, что любое онкологическое заболевание является противопоказанием к примению витаминных препаратов, и у большинства практикующих врачей сложилось мнение о пагубном их влиянии на прогрессирование онкологичнского процесса.
Тем не менее в мировой литературе накоплено небольшое число исследований, проведённых с целью изучения влияния приёма витаминов на прогноз онкологического заболевания. Среди них наиболее старой является методика высокодозовой терапии витамином С. За более чем 30-летнюю историю существования от применения высоких доз (от 10 до 65 граммов в сутки) аскорбиновой кислоты был зафиксирован лишь единый случай регрессии заболевания у больного ретикулосаркомой с метастазами в лёгкие, остальные исследования показали смешанные результаты. [1] Но в настоящее время витамин С продолжает использоваться в некоторых онкологических клиниках совместно с химиопрепаратами, и появляются данные о том, что при внутривенной инфузии аскорбиновая кислота способна вызывать оксидативный стресс путём генерации молекул перекиси водорода, селективно влияющие на опухолевые клетки поджелудочной железы. [2]
В отношении рака поджелудочной железы американскими учёными было проанализировано большое количество работ, доказывающих положительное влияния назначение витаминов А, С, D, E и К пациентам с этим заболеванием, которое выражается в усилении противоопухолевого действия химиопрепаратов. [3]
В Дании был создан целый протокол ARICA (Adjuvant Nutritional Intervention in Cancer), в соответствие с которым 32 больным раком молочной железы с наличием метастазов в подмышечных лимфоузлах в дополнение к основному (хирургическое и химиотерапия) лечению использовалось потребление витаминного коктеля, содержащего витамин С, Е, бета-каротины, селен, омега — 3ПНЖК и конэзим-Q10. В течение 18 месяцев наблюдения ни одна больная не умерла, ни у одной не выявлено признаков отдалённого метастазирования, у большинства улучшилось качество жизни в виде увеличения массы тела и снижения потребности в анальгетиках. [4]
Связь качества жизни больных онкологическим заболеваением отмечена с дефицитом витамина D [5] однако вопрос о его профилактической и лечебной эффективности в отношении онкологических заболеваний до настоящего времени остаётся нерешённым и требует дальнейшего изучения. [6]
Итого, можно сказать, что в настоящее время доказательная медицина располает крайне малым материалом, посвященному применению витаминов у онкологических больных. Но и на основании имеющегося нельзя однозначно утверждать об их абсолютном противопоказании для больных опухолевыми заболеваниями.
Куда больше накопленно всевозможной информации о влиянии приёма различных витаминных препаратов на риск развития онкологических заболеваний. Возвращаясь к витамину С, стоит отметить, что по данным одних исследований у него обнаружен профилактический эффект в отношении рака лёгкого, вплоть до установления прямой зависимости — риск рака лёгкого снижается на 7% при увеличение суточной дозы потребления аскорбата на 100 мг. [7] Но результаты крупнейшего мета-анализа 758 клинических исследований, включивших более 62 тыс. пациентов не выявил значимой связи между употреблением витамина С и риском развития онкологических заболеваний с учётом суточной дозы аскорбиновой кислоты, типа рака, пола пациента, его национальности и наличия табакокурения. [8]
Анализ 19 клинических исследований с участием более 10 тыс. пациентов с раком лёгких показал, что между приёмом витамина А и бета-каротина и риском развития рака лёгкого существует связь, однако её значения меняются в зависимости от пола пациента и ареала его обитания. [9] Так в исследовании на европейской популяции пациентов высокие дозы бета-каротинов опасны в отношении увеличения частоты рака лёгких. [10]
Другой мета-анализ с участие более 4 тыс. американских больных раком лёгкого выявил протективное влияние употребления витамина Е на риск возникновения этого заболевания. [11]
Во Франции по результатам двойного слепого плацебо-контролируемого исследования «SUpplementation en VItamines et Minéraux AntioXidants» (SU. VI. MAX) study было показано, что ежедневное потребление витамина Е в дозе 30 мг и бета-каротинов в дозе 6 мг снижает частоту онкологических заболеваний у наблюдаемых пациентов. [12]
Несмотря на это витамин Е остаётся самым противоречимым витамином, так как в отношении его есть данные, говорящие об усилении риска возникновения рака почки [13] и рака предстательной железы. [14] при его повышенном употреблении.
Витамин D можно считать наиболее изучаемым, в последние годы. Получены данные о связи дефицита этого витамина и риском развития рака простаты [15, 16] рака мочевого пузыря [17] и наиболее злокачественной формой рака молочной железы — тройной негативный рак, которые не содержит на поверхности своих клеток рецепторов ни к эстрогену, не прогестерону, ни к эпидермальному фактору роста опухоли — her2neu. [18]
Проволжаются исследования, пытающиеся выявить этиологическую составляющую в развитии определённого онкологического заболевания в дефиците того или иного нутриента. Так в британском исследование на 66 тысяч жителей было продемонстрирована важность ежедневного потребления достаточного (не менее 100 мг/сут) количества магния, как в виде добавок, так в составе мультивитаминных комплексов для первичной профилактики рака поджелудочной железы. [19]
В итальянском проспективном исследовании с участием боле 45 тысяч людей на протяжении 11 лет изучалось влияние характера питания на развитие колоректального рака. Было показано, что дополнительный приём витаминов С, Е и бета-каротинов не оказывает протективного влияния на развитие данного заболевания. [20]
В целом, проблема дефицита и наоборот повышенного потребления витаминов, как факторов риска развития онкологических заболеваний отсаётся открытой и требует дальнейшей проработки и масштабных исследований.
Литература:
1. High-Dose Vitamin C (PDQ®): Health Professional Version. (http: //www. ncbi. nlm. nih. gov/pubmed/26389504) ].
2. Cieslak J. A. , Cullen J. J. Treatment of Pancreatic Cancer with Pharmacological Ascorbate. Curr Pharm Biotechnol. 2021;16 (9): 759-70.
3. Davis-Yadley A. H. , Malafa M. P. Vitamins in Pancreatic Cancer: A Review of Underlying Mechanisms and Future Applications. Adv Nutr. 2021 Nov 13;6 (6): 774-802. doi: 10. 3945/an. 115. 009456.
4. Lockwood K. , Moesgaard S. , Hanioka T,, Folkers K. Apparent partial remission of breast cancer in ‘high risk’ patients supplemented with nutritional antioxidants, essential fatty acids and coenzyme Q10. Mol Aspects Med. 1994;15 Suppl: s231-40.
5. Martínez-Alonso M. , Dusso A. , Ariza G. , Nabal M. Vitamin D deficiency and its association with fatigue and quality of life in advanced cancer patients under palliative care: A cross-sectional study. Palliat Med. 2021 Aug 27. pii: 0269216315601954.
6. Tagliabue E. , Raimondi S. , Gandini S. Vitamin D, Cancer Risk, and Mortality. Adv Food Nutr Res. 2021;75: 1-52. doi: 10. 1016/bs. afnr. 2021. 06. 003.
7. Luo J. , Shen L. , Zheng D. Association between vitamin C intake and lung cancer: a dose-response meta-analysis. Sci Rep. 2021 Aug 22;4: 6161. doi: 10. 1038/srep06161.
8. Lee B. , Oh S. W. , Myung S. K. Efficacy of Vitamin C Supplements in Prevention of Cancer: A Meta-Analysis of Randomized Controlled Trials. Korean J Fam Med. 2021 Nov;36 (6): 278-285. Epub 2021 Nov 20.
9. Yu N. , Su X. , Wang Z. , Dai B. et. al. Association of Dietary Vitamin A and β-Carotene Intake with the Risk of Lung Cancer: A Meta-Analysis of 19 Publications. Nutrients. 2021 Nov 11;7 (11): 9309-24. doi: 10. 3390/nu7115463.
10. Malvy D. J. , Favier A. , Faure H. , Preziosi P. et. al. Effect of two years’ supplementation with natural antioxidants on vitamin and trace element status biomarkers: preliminary data of the SU. VI. MAX study. Cancer Detect Prev. 2001;25 (5): 479-85.
11. Chen G. , Wang J. , Hong X. , Chai Z. et. al. Dietary vitamin E intake could reduce the risk of lung cancer: evidence from a meta-analysis. Int J Clin Exp Med. 2021 Apr 15;8 (4): 6631-7. eCollection 2021.
12. Malvy D. J. , Favier A. , Faure H. , Preziosi P. et. al. Effect of two years’ supplementation with natural antioxidants on vitamin and trace element status biomarkers: preliminary data of the SU. VI. MAX study. Cancer Detect Prev. 2001;25 (5): 479-85.
13. Shen C. , Huang Y. , Yi S. , Fang Z. et. al. Association of Vitamin E Intake with Reduced Risk of Kidney Cancer: A Meta-Analysis of Observational Studies. Med Sci Monit. 2021 Nov 8;21: 3420-6.
14. Key T. J. , Appleby P. N. , Travis R. C. , Albanes D. Carotenoids, retinol, tocopherols, and prostate cancer risk: pooled analysis of 15 studies. Am J Clin Nutr. 2021 Nov;102 (5): 1142-57. doi: 10. 3945/ajcn. 115. 114306.
15. Trummer O. , Langsenlehner U. , Krenn-Pilko S. , Pieber T. R. et. al. Vitamin D and prostate cancer prognosis: a Mendelian randomization study. World J Urol. 2021 Jul 25.
16. Deschasaux M. , Souberbielle J. C. , Latino-Martel P. , Sutton A. et. al. A prospective study of plasma 25-hydroxyvitamin D concentration and prostate cancer risk. Br J Nutr. 2021 Nov 16: 1-10.
17. Zhang H. , Zhang H. , Wen X. , Zhang Y. et. al. Vitamin D Deficiency and Increased Risk of Bladder Carcinoma: A Meta-Analysis. Cell Physiol Biochem. 2021 Nov 9;37 (5): 1686-1692.
18. Abulkhair O. , Saadeddin A. , Makram O. , Gasmelseed A. et. al. Vitamin D Levels and Breast Cancer Characteristics: Findings in Patients from Saudi Arabia. J Steroid Biochem Mol Biol. 2021 Nov 7. pii: S0960-0760 (15) 30129-1. doi: 10. 1016/j. jsbmb. 2021. 11. 003.
19. Dibaba D. , Xun P. , Yokota K. , White E. et. al. Magnesium intake and incidence of pancreatic cancer: the VITamins and Lifestyle study. Br J Cancer. 2021 Nov 10. doi: 10. 1038/bjc. 2021. 382.
20. Vece M. M. , Agnoli C. , Grioni S. , Sieri S. et. al. Dietary Total Antioxidant Capacity and Colorectal Cancer in the Italian EPIC Cohort. PLoS One. 2021 Nov 13;10 (11): e0142995. doi: 10. 1371/journal. pone. 0142995.
Статья добавлена 5 декабря 2021 г.
Лучевая терапия в россии
Уровень отечественных онкологов, медицинских физиков, лучевых терапевтов, при условии постоянного повышения их квалификации (что является обязательным для специалистов МИБС), не уступает, а, зачастую, превосходит уровень ведущих мировых специалистов.
Широкая клиническая практика позволяет быстро получать значительный опыт даже молодым специалистам, парк оборудования регулярно пополняется новейшими аппаратами для лучевого лечения от лидеров отрасли (даже в таких затратных сферах, как протонная терапия и радиохирургия).
Поэтому все чаще иностранные граждане, даже из тех стран, которые считаются традиционным “пунктом назначения” для выездного медицинского туризма из России, вдохновленные успехами российской медицины, выбирают лечение рака в частных онкоцентрах Российской федерации, в том числе, и в МИБС.
Ведь стоимость лечения рака за границей (при сравнимом уровне качества) выше не из-за качества медицины, а из-за уровня заработных плат иностранных специалистов и накладных расходов, связанных с перелетом, проживанием пациента и его сопровождающих, услугами переводчиков и т.д.
При этом доступность качественной лучевой терапии для граждан России, в рамках гарантированного государством объема медицинской помощи, оставляет желать лучшего. Государственная онкология все еще недостаточно оснащена современной техникой для диагностики и лечения, бюджеты государственных онкоцентров не позволяют на должном уровне обучать специалистов, высокая загруженность сказывается на качестве подготовки и планирования лечения.
С другой стороны, схема работы страховой медицины в России формирует спрос на наиболее дешевые методы, обеспечивающие лишь базовый уровень качества лечения рака, не создавая спроса на высокотехнологичные методы лечения, к которым относятся радиотерапия, радиохирургия, протонная терапия. Это отражается в низком уровне квот на лечение в рамках программы медицинского страхования.
Исправить положение призваны эффективно управляемые частные онкологические центры, предлагающие пациентам ту тактику лечения, которая будет оптимальной как с точки зрения эффективности, так и с точки зрения стоимости.

Так выглядит Центр протонной терапии Медицинского института Березина Сергея (МИБС)
Если Вы стоите перед непростым выбором, где начать лечение рака, обратитесь в Онкологическую клинику МИБС. Наши специалисты предоставят квалифицированную консультацию относительно выбора подходящего метода лучевой терапии и другого лечения (в соответствии с лучшими стандартами мировой онкологии), прогноза и стоимости такого лечения.
В случае, если требуется необходимость проверить адекватность рекомендуемых в другом онкоцентре методов и плана лечения потребностям Вашего клинического случая, в любом из Центров МИБС (как в России, так и за ее пределами) Вам будет предложено “второе мнение” относительно установленного диагноза, рекомендованного состава и объема лечения.
Запишитесь сейчас!
Общее побочное действие лучевой терапии
Эмоциональное состояние
Почти все пациенты, находящиеся на лечении по поводу рака, испытывают в той или иной степени эмоциональное напряжение. Наиболее часто наблюдается чувство депрессии, страха, тоски, одиночества, иногда агрессии. По мере улучшения общего состояния эти эмоциональные нарушения притупляются.
Чаще общайтесь с членами семьи, близкими друзьями. Не замыкайтесь в себе. Старайтесь принимать участие в жизни окружающих Вас людей, помогайте им и не отказывайтесь от их помощи. Поговорите с психотерапевтом. Возможно, он порекомендует какие-нибудь приемлемые методы снятия напряжения.
Усталость
Чувство усталости обычно начинает ощущаться через несколько недель после начала лечения. Оно связано со значительной физической нагрузкой на организм при проведении лучевой терапии и стрессом. Поэтому на период проведения лучевой терапии следует несколько снизить общую активность, особенно если Вы привыкли работать в напряженном темпе.
Однако не устраняйтесь полностью от занятий домашним хозяйством, принимайте участие в семейной жизни. Чаще занимайтесь делами, которые Вам по душе, больше читайте, смотрите телевизор, слушайте музыку. Но только до тех пор, пока не почувствуете себя усталым.
Если Вы не хотите, чтобы о Вашем лечении знали посторонние, можно взять отпуск на период лечения. Если Вы продолжаете работать, побеседуйте со своим руководителем, — возможно, он изменит Ваш график работы. Не бойтесь обратиться за помощью к своим родным и друзьям.
Изменения крови
При облучении значительных по размерам участков тела в крови может временно уменьшиться количество лейкоцитов, тромбоцитов и эритроцитов. Врач контролирует функцию кроветворения по данным анализа крови. Иногда при выраженных изменениях делают перерыв в лечении на одну неделю. В редких случаях назначают лекарственные препараты.
Ухудшение аппетита
Обычно радиотерапия не вызывает тошноты и рвоты. Однако может наблюдаться ухудшение аппетита. Вы должны понимать, что для восстановления поврежденных тканей следует употреблять достаточное количество пищи. Даже если нет чувства голода, необходимо приложить усилия и обеспечить высококалорийное питание с высоким содержанием белков. Оно позволит лучше справиться с побочными явлениями и повысить результаты лечения онкологического заболевания.
Несколько советов по питанию при проведении лучевой терапии:
- Употребляйте разнообразную пищу часто, но малыми порциями. Ешьте тогда, когда Вам захотелось, не обращая внимания на распорядок дня.
- Повышайте калорийность пищи — добавляйте больше сливочного масла, если Вам нравится его запах и вкус.
- Для повышения аппетита используйте разнообразные соусы.
- В промежутках между приемами пищи употребляйте кефир, смесь молока с маслом и сахаром, йогурт.
- Употребляйте больше жидкости, лучше соков.
- Всегда имейте небольшой запас нравящихся Вам продуктов питания (разрешенных к хранению в клинике, в которой проводится лечение) и ешьте их, когда у Вас возникает желание что-то поесть.
- Во время еды старайтесь создать условия, повышающие настроение (включайте во время еды телевизор, радиоприемник, слушайте любимую музыку).
- Посоветуйтесь со своим врачом, можно ли во время еды для повышения аппетита выпить стакан пива.
- Если у Вас имеются какие-либо заболевания, требующие соблюдения определенной диеты, посоветуйтесь со своим врачом о том, как разнообразить рацион питания.
Профессор нмиц онкологии: лучевая терапия балансирует между добром и злом, но альтернативы нет
Миллиард рублей Петербургский терфонд ОМС направит в 2020 году на современную лучевую 3D-терапию для пациентов с онкологическими заболеваниями. Как говорит профессор Сергей Новиков, это может на 10-15% увеличить выживаемость пациентов с диагнозом «рак». Только в Петербурге современные технологии есть лишь в федеральных клиниках.
В комплексной терапии онкологических заболеваний используются 4 метода лечения: хирургия, химиотерапия, лучевая терапия, иммунотерапия. Сейчас самое большое финансирование и все внимание брошены на лекарственную терапию. Но со следующего года грядут изменения и в лучевой. А это для Петербурга – самое больное место.
Как говорит профессор Сергей Новиков, заведующий отделением лучевой терапии НМИЦ онкологии им Петрова, за последнее десятилетие лучевая терапия сделала большой рывок и ее стремительное развитие не останавливается. Появились новые аппараты, новые технологии, а с ними — новая идеология лучевой терапии.
— Сергей Николаевич, правда ли, что новые технологии в лучевой терапии когда-то заменят хирургию?
— Во многих случаях это уже происходит. Например, только что мы составляли план лечения пациента с ранним немелкоклеточным раком легкого. У него нет изменений в лимфоузлах, нет метастазирования. Но его невозможно прооперировать из-за сопутствующих заболеваний (перенес инфаркт, инсульт), так что операция угрожает жизни. В этой фактически патовой ситуации лучевая терапия позволяет провести радикальное лечение — мы можем подвести чрезвычайно высокую дозу излучения на очень маленький объем тканей. И это приведет не к продлению жизни, а именно к излечению. Опухоли объемом 1-5 см мы можем облучить, избежав при этом серьезного повреждения окружающих тканей. Это называется стереотаксическая лучевая терапия или радиохирургия.
— Вы имеете в виду лечение с помощью гамма-ножа и кибер-ножа?
— Эти технологии тоже относятся к стереотаксической лучевой терапии — гамма-нож применяют для лечения новообразований на головном мозге, а кибер-нож — для направленного радиотерапевтического воздействия на экстракраниальные опухоли (расположенные вне головного мозга). Но сейчас активно развиваются технологии радиохирургии и стереотаксической лучевой терапии на линейных ускорителях. Их преимущество в том, что это универсальные приборы: на одном аппарате может выполняться — стерео-, радио- или классическая лучевая терапия с избирательным воздействием на опухоль (обычная или 3D-конформная). У нас уже три таких аппарата, каждый из них имеет свои преимущества, а в целом умеют все.
— Для лечения какого вида рака они предназначаются, что умеют?
— Легче перечислить, что не умеют — не умеют облучать очень много очагов в головном мозге одномоментно, в отличие от гамма ножа. Но такая ситуация — редкость, а главное, пока нет доказательств целесообразности такой агрессивной терапии, она не продлевает жизнь.
С другой стороны, эти аппараты могут делать все в области высокотехнологичного облучения, когда требуется радиохирургия: используются в комплексном лечении новообразований в головном мозге, локализованных процессах в легких (немелкоклеточный рак), метастатических поражений легких, печени, надпочечников, костей, мягких тканей и т. д. Благодаря высокой точности направления воздействия, они незаменимы в лечении злокачественных новообразований головы и шеи. Например, опухоль языка — очень тяжелая патология, лечить ее хирургически или невозможно, или очень сложно. После операции пациента берем мы. Активно используем методы брахитерапии и стереотаксической лучевой терапии при раке предстательной железы.
Онкологи сегодня говорят, что иммунотерапия перевернула наше сознание в лечении некоторых видов рака. Но забывают упомянуть, что сочетание иммунотерапии с некоторыми видами лучевой терапии увеличивает эффективность практически в два раза. Поэтому трудно встретить протоколы лечения, в которых рекомендована иммунотерапия без лучевой терапии.
— Но ведь считается, что при раке предстательной железы «золотой стандарт» — брахитерапия.
— Да, но для ослабленных и пожилых пациентов мы используем стереотаксис, потому что это неинвазивное — щадящее лечение. С моей точки зрения, пациенты с этим диагнозом должны получать прежде всего лучевую терапию, хотя на протяжении многих лет считалось, что главный способ лечения рака предстательной железы – хирургия. Но простатэктомия сопряжена с риском для жизни, с осложнениями — каждый пятый после хирургического вмешательства страдает недержанием мочи, у 70% перенесших операцию возникает нарушение эректильной функции. Эффективность хирургии, брахитерапии и стереотаксической лучевой терапии с точки зрения борьбы с опухолью одинаковая, в некоторых случаях лучевое лечение даже более результативно. Но недержание мочи после него – редкость, всего 1-2% случаев в сравнении с 20% после хирургического удаления предстательной железы и тут даже использование роботизированных хирургических методов не помогает улучшить результаты. Эректильная дисфункция, к сожалению, может возникнуть и после проведения лучевого лечения — у 30-40% пациентов мы отмечаем снижение эректильной функции. Но, к счастью, это существенно меньше 70-80% после хирургического лечения.
— Однако по-прежнему распространен миф о том, что лучевая терапия опасна, потому что может спровоцировать развитие лучевой болезни.
— Если под лучевой болезнью мы подразумеваем то, что происходит с организмом человека, оказавшегося в эпицентре взрыва ядерной бомбы, то даже в 1970 годы лучевая терапия ее не провоцировала. Другое дело, что когда использовали большие поля для облучения, это вызывало разного рода токсичность — развивались осложнения со стороны органов дыхательной или кроветворной системы, например. Я начал работать в 1980-е, и уже тогда были разработаны методы, которые позволяли избегать фатальной или очень серьезной токсичности. Хотя какие-то неприятности от лучевой терапии были, есть и будут. Например, если мы подводим очень высокие дозы в область опухоли предстательной железы, мы можем вызвать повреждения прямой кишки, если облучаем опухоль в легких, — повреждения легких, в мозге — здоровые ткани мозга. И иногда вынуждены рисковать, потому что понимаем: другой возможности спасти человека нет. Да, бывает, лучевая терапия балансирует между добром и злом, но зачастую альтернативы нет. Например, при метастазах в головном мозге — это пациенты, которым часто нейрохирурги уже помочь не могут, возможности химиотерапии, нередко, исчерпаны. А лучевая терапия у таких пациентов ассоциируется с 20-30% риском возникновения лучевого некроза. Но в оставшихся 70-80% случаев есть шанс, что мы поможем пациенту преодолеть на определенное время его проблемы.
— Стереотаксическая лучевая терапия – не самая распространенная технология в Петербурге, возможности для ее применения есть только у двух федеральных специализированных клиник и у одной негосударственной. Часто ли она востребована?
— Когда у нас только появился первый аппарат для стереотаксиса, мы пролечили всего 12 пациентов. Это была, можно сказать, эксклюзивная методика — все отделение собиралось смотреть. А в этом году стереотаксическую лучевую терапию получили уже 350 пациентов, то есть около 20% получивших лучевое лечение в НМИЦ онкологии им. Н.Н. Петрова.
— Парадокс: при том, что в Петербурге можно получить самые современные виды лучевой терапии, петербуржцев направляют на лучевое лечение в клиники, в которых их нет. Более того, на 2020 год из средств петербургского фонда ОМС выделяется 1 млрд рублей на 3D-конформную терапию, выполнять которую в городских специализированных клиниках, можно сказать, не на чем.
— Правильное лечение онкологического заболевания подразумевает использование лучевой терапии в 50-70% случаев. В пересчете на пациентов это много, учитывая, что, например, в прошлом году почти у 26 тысяч петербуржцев диагноз «рак» установлен впервые. Сегодня нижняя планка, по сути, базовый метод лучевого лечения, — 3D-конформная лучевая терапия — ниже мы не должны опускаться в соответствии с концепцией, принятой в нашей стране, а она — все ближе к той, по которой лечат рак в развитых странах. Ее повсеместное применение на 10-15% должно повысить выживаемость. 1 млрд на 3D-конформную терапию — серьезный шаг к тому, чтобы в Петербурге лечение онкологических пациентов вышло на новый уровень.
— Только кто и на каком оборудовании будет ее проводить? В городских медицинских учреждениях нет современных ускорителей. Да и старые регулярно выходят из строя.
— Мы сражаемся за то, чтобы петербуржцы могли получать современное эффективное лучевое лечение. Но НМИЦ им. Петрова не может принять всех, хотя пока мы никому не отказывали.
Что касается стереотаксической лучевой терапии, которая есть в единичных клиниках Петербурга, мы примерно на 30% увеличиваем объемы ежегодно. И готовы взять на себя столько пациентов, сколько нужно. Поскольку у нас стереотаксическая лучевая терапия проводится на тех же аппаратах, на которых проводится и классическая, чтобы освободить их от загрузки стандартной 3D-конформной лучевой терапией, мы приобрели еще один линейный ускоритель, на котором и будем ее выполнять.
— «Можем принять не всех» — это та самая проблема, из-за которой пациенты либо не получают эту помощь вообще, либо получают ее на аппаратах, которые нельзя отнести к современным.
— В Городском онкологическом центре в Песочном и в Городском онкологическом диспансере недостаточно современных линейных ускорителей, на которых можно проводить 3D-конформную лучевую терапию. И мне кажется, что на аппаратах, которые там есть, невозможно использовать сложные технологии, например, радиохирургическое лечение и стереотаксическую лучевую терапию. Поэтому важно, чтобы руководители городской онкологической службы наладили сотрудничество с федеральными учреждениями, частными клиниками, которые готовы и могут помочь петербуржцам.
Конечно, нужно обновлять парк оборудования. Потому что на аппаратах 2001-2005 года, которые морально устарели, а многие уже сняты с производства, можно выполнять паллиативную лучевую терапию, использовать простые методики облучения, но современные достижения радиационной онкологии на них недоступны.
У городских клиник есть рентген-терапия, которой, кстати, у нас нет, в онкодиспансере есть интраоперационный ускоритель, которого больше нет ни у кого в нашем городе.
Задача — дать пациентам возможность получать все существующие на сегодня виды лучевой терапии по показаниям: простую, когда ее достаточно, сложную, когда она необходима. Понимаете, если у мужчины выявили рак предстательной железы, и он попадает в учреждение, где нет аппаратов для проведения стереотаксической лучевой терапии, нет брахитерапии, то, на мой взгляд, он адекватной помощи в этих учреждениях получить не сможет. Потому что если будут подведены достаточно большие дозы на устаревших линейных ускорителях, серьезно вырастут осложнения, если дозы будут меньше, чем необходимы для борьбы с опухолью, то лечение не будет эффективным. Да, часть пациентов выздоровеет, но меньше, чем тот процент, который мог бы и должен был выздороветь. А пациенты, которым можно провести более простую лучевую терапию, должны лечиться там, где она есть, — нет смысла направлять их в НМИЦ онкологии.
То есть Петербургу нужна грамотная маршрутизация. Но это очень болезненный вопрос для городских властей. Тут все должны понимать, что его нужно решать, и мы к этому готовы.
— До сих пор федеральные клиники лечили, конечно, петербуржцев, но – по федеральным квотам. И объясняли это тем, что тарифы ОМС на лучевую терапию слишком малы. А количество квот всегда ограничено.
— Те тарифы, что действуют в системе ОМС сейчас, рассчитаны на ту простую лучевую терапию, что есть в городских клиниках. Мы работаем в рамках программы ВМП, потому что используем технологии, которых нет в городских медучреждениях. Программа ВМП рассчитана на то, что люди могут получить помощь там, где ее могут оказать. И ее финансирование было достаточным, чтобы применять в лечении сложные технологии: закупать дорогие расходники, заниматься техническим обслуживанием оборудования. Теперь, насколько я знаю, запланированные на 2020 год тарифы петербургского фонда ОМС эквивалентны тарифам, действующим в программе ВМП.
— На 1 миллиард рублей запланировано 4 тысячи курсов 3Д-конформной терапии. 4 тысячи пациентов ее получат – это много или мало?
— Немало, но 4 тысячи курсов это не 4 тысячи пациентов. Потому что некоторым приходится проводить их повторно. Например, прошла женщина курс терапии по поводу опухоли в молочной железе, но обнаружился метастаз в лимфоузле или в другом месте, его тоже нужно облучать. Я думаю, что это 3-3,5 тысячи пациентов.
Для сравнения: в НМИЦ онкологии в год лучевую терапию получают 2 тысячи пациентов. Приблизительно столько же — РНЦРХТ им. Гранова. Эту помощь могут оказывать в частных клиниках МИБС и есть один современный ускоритель и аппараты для брахитерапии в ПСПбГМУ им. Павлова. То есть в городе можно выполнять лучевую терапию любой сложности. Важно, чтобы средства были потрачены на ее эффективные методы.
— Люди по-прежнему едут за рубеж, чтобы получить лечение радиоактивным йодом. Почему в России оно до сих пор дефицитное, а в Петербурге его и вовсе нет?
— Это не сложная технология, но для ее применения у нас действуют очень строгие требования, вплоть до строительства специальных очистных сооружений. Чтобы выполнить все, что нужно по нормативам, надо выиграть большое сражение, но сначала вложить в его подготовку огромные деньги. Сейчас предпринимаются усилия, чтобы сделать наше законодательство более демократичным — смягчить требования для применения этой технологии. А мы уже фактически готовы к тому, чтобы использовать ее, даже обсуждаем возможность открытия коек для пациентов, нуждающихся в терапии радиоактивными источниками. Эта терапия — это огромная перспектива на будущее.
Сегодня это, в первую очередь, радиойодотерапия или паллиативная терапия при метастазах в кости — она позволяет сделать комфортной жизнь человека, страдающего от болевого синдрома. Это то, к чему мы уже сегодня готовы. Но есть еще много методик использования радиоактивных источников. Например, лечение препаратами, мечеными лютецием, — это широкий круг препаратов, которые избирательно накапливаются в опухоли и уничтожают ее. То есть это один из вариантов целенаправленной терапии.
— Сегодняшняя онкология построена на как можно большей целенаправленности. Часто пациенты слышат от химиотерапевтов о таргетной терапии, которая «бьет точно в цель», вы говорите о стереотаксисе… Действительно ли мы можем воздействовать на опухоль точечно, абсолютно не повреждая окружающие ткани?
— Магической пули, которая бьет только в цель пока нет. И при таргетной терапии избирательность условная, и при стереотаксическом — какая-то доза облучения все же приходится на здоровые ткани и они могут пострадать. Но все же воздействие современных лучей и химиотерапии, действительно, выигрывает в эффективности и точности направленного действия.
— Что нужно сделать, чтобы в лучевой терапии новые технологии появлялись не только в федеральных клиниках? Закупать новые аппараты?
— Я счастлив, что лучевая терапия в нашей стране начала осознано развиваться. Но это огромная машина, она не сдвинется с места мгновенно. Чтобы ее раскрутить, нужно потратить много сил и времени, грамотно использовать финансовые вложения.
То есть миллиарды сначала должны вкладываться не в оборудование, а в людей. Их нужно учить, в том числе за границей, нужно обеспечить их достойным заработком. А когда будут люди, способные работать на современном оборудовании, тогда и нужно его покупать.
— Сколько всего аппаратов для лучевой терапии работают у вас?
— Четыре ускорителя — от самого простого до самого сложного, и еще два аппарата – для брахитерапии. Плюс много компьютерных планирующих систем, задача которых сделать лучевую терапию максимально точной.
Источник
Точное дозирование
Эволюция безопасности лучевой терапии начиналась с точного определения толерантных (не вызывающих необратимых биологических изменений) доз ионизирующего излучения для различных типов здоровых тканей организма. Одновременно с тем, как ученые научились контролировать (и дозировать) количество излучения, начались работы по управлению формой поля облучения.
Современные аппараты для лучевой терапии позволяют создавать зону высокой дозы излучения, отвечающую форме опухоли, из нескольких полей в зоне их пересечения. При этом форма каждого поля моделируется управляемыми многолепестковыми коллиматорами (специальное электромеханическое устройство, “трафарет”, принимающий заданные формы и пропускающий поле требуемой конфигурации). Поля подаются из различных позиций, что распределяет общую дозу радиации между различными здоровыми частями организма.

Слева — конвенциональная лучевая терапия (3D-CRT) — зона высокой дозы излучения (зеленый контур) сформирована на пересечении двух полей, она превышает объем расположения опухоли, что ведет к повреждению здоровых тканей, как в зоне пересечения, так и в зоне прохождения двух полей высокой дозы.
Справа — модулируемая по интенсивности лучевая терапия (IMRT) — зона высокой дозы, сформированная пересечением четырех полей. Ее контур максимально приближен к контуру новообразования, здоровые ткани на пути прохождения полей получают, как минимум, вдвое меньшую дозу. В настоящее время при IMRT не редкость применение десяти и более полей, что значительно снижает общую лучевую нагрузку.