Бады. не навреди здоровью | управление роспотребнадзора по республике мордовия
Сегодня, наверное, не встретишь человека, который бы ни разу не слышал такое сочетание букв-БАД. Многие знают, что это расшифровывается как «биологически активная добавка». Всего три буквы и три слова, но как много за ними стоит. В настоящее время медицинское сообщество разделилось на два лагеря: один за употребление БАД, другой против. Давайте попробуем разобраться в том, что мы знаем о БАДах и что еще нужно знать, чтобы не навредить своему здоровью. Несмотря на то, что практически все медицинские теории и взгляды на развитие заболеваний и принципы их лечения за многие века претерпели большие изменения, связанные с открытием новых механизмов развития заболеваний и методов диагностики и лечения, непоколебимым осталось только одно единодушное мнение медицинского сообщества: чем хуже питание, тем больше болезней может поразить человека. Специалисты утверждают, что рацион питания человека в наши дни должен содержать более 600 различных веществ. Однако, к большому сожалению, сбалансированный по всем пищевым веществам рацион могут себе позволить далеко не все. Вот тут-то и приходят на помощь биологически активные добавки-концентраты натуральных природных веществ, выделенные из пищевого сырья животного, морского, минерального, растительного происхождения или же полученные путем химического синтеза вещества, идентичные природным аналогам. Подавляющее их большинство обладает различными свойствами, которые могут помочь организму справиться с негативным воздействием окружающего мира при условии поступления в организм в определенных количествах, пропорциях и сочетаниях. Однако БАДы не работают вместо регуляторных систем организма, а всего лишь помогают устранять дефицит или избыток каких-либо соединений в организме человека.
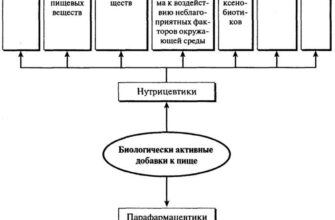
Важно знать! От БАДов необходимо отличать добавки, которые используются в пищевой промышленности для придания вкуса, цвета и формы некоторым продуктам, — они не являются биологически активными. В зависимости от действия БАДы делят на три категории: нутрицевтики, эубиотики, парафармацевтики.
Нутрицевтики-это незаменимые (эссенциальные) компоненты пищи, такие как витамины или их предшественники, полиненасыщенные жирные кислоты, минеральные вещества и микроэлементы, отдельные аминокислоты, некоторые моно-и дисахариды и т.д. Так как в основном это природные ингредиенты пищи, которые не могут откладываться «про запас» в организме, то должны постоянно присутствовать в нашем пищевом рационе. Нутрицевтики, как правило, применяются для коррекции химического состава пищи и насышения организма пищевыми веществами, однако полностью заменить еду они не могут. С помощью нутрицевтиков можно оздоровить организм, предупредить развитие заболевания, но излечить болезнь нельзя.
Парафармацевтики-это вещества, которые применяются для профилактики, а также в качестве вспомогательной терапии для поддержания правильной активности органов и систем. В основном это органические компоненты пищевых и лекарственных растений, продукты, выделенные из сырья морского и животного происхождения. Как правило, сюда входят органические кислоты, биофлавониды, кофеин, биогенные амины и др.
Эубиотики-биологически активные добавки к пище, в состав которых входят живые микроорганизмы и (или) их продукты метаболизма, оказывающие нормализующее воздействие на состав и биологическую активность микрофлоры пищеварительного тракта.
Созданные на основе естественных микроорганизмов кишечника человека (бифидобактерий, лактобактерий и др.), они ограничивают размножение «вредных» микроорганизмов, применяются для нормализации состава и функционирования сапрофитной кишечной микрофлоры. Большое значение имеют для профилактики и при вспомогательной терапии широко распространенных дисбактериозов.
Основные виды воздействия БАДов на организм:
-Очищение-выделение из организма различных токсинов (солей тяжелых металлов, свободных радикалов, очищение от слизи, шлаков, камней и т.д.).
-Восполнение-устранение дефицита микроэлементов, витаминов, аминокислот и других важных компонентов с учетом физиологических потребностей организма.
-Восстановление-стабилизация работы всех органов и систем, восстановление нормального обмена веществ. Теоретически каждая биологически активная добавка должна обладать всеми этими тремя свойствами, однако чаще всего у одних преобладают одни свойства, у других другие. Поэтому при применении обычно придерживаются такой схемы: сначала очищение, затем удовлетворение потребностей в недостающем, а в заключение-восстановление и укрепление здоровья.
ОБРАТИТЕ ВНИМАНИЕ! БАДы НЕ ЛЕЧАТ! Они не являются лекарственными препаратами, не проходят установленную для лекарств процедуру доклинических и клинических испытаний. БАД является пищевым продуктом, призванным восполнить недостаток некоторых элементов в организме, и такой недостаток должен быть подтвержден.
На сегодняшний день на территории России зарегистрировано более 3,5 тысячи БАДов. На фармацевтическом рынке можно найти добавки в виде экстрактов, настоев, бальзамов, порошков, сухих и жидких концентратов, брикетов, сборов, растительных чаев, сиропов, таблеток и капсул. И, как правило, все они содержат достаточно большое число компонентов, использующихся при их изготовлении. Список составляющих компонентов одного БАДа может доходить до 20 наименований, и не всегда все эти компоненты полезны, и разрешены к применению. Одной из самых больших групп БАДов является группа лечебно-профилактических чаев. Эта группа называется так не из-за того, что в их состав входят листья чая, а потому, что их заваривают так же, как заваривают чай. По своему эффекту многие такие чаи подобны лечебным препаратам, которые изготавливают из растительного сырья. Так, например, именно лечебно-профилактические чаи, в состав которых входят лекарственные растения, морепродукты и минералы являются одной из основ китайской и тибетской народной медицин.
Также необходимо отметить, что к БАДам относятся только те микронутриенты (например, витамины), суточная дозировка которых не должна превышать тройной дозировки от рекомендуемой величины их суточного потребления. Исключениями из этого правила являются витамин Е и аскорбиновая кислота. Они единственные компоненты БАД, суточную дозу которых можно превышать в 10 раз. Это обусловлено их уникальными специфическими функциями, в том числе связанными со снижением риска развития многих заболеваний (при приеме таких доз). Содержание минеральных веществ в составе БАД не должно превышать суточной величины их физиологической потребности
Так полезны ли БАДы? Казалось бы, в БАДах нет ничего плохого, и они не содержат в себе сильнодействующих, ядовитых и лекарственных средств, поэтому они безопасны. Однако существует целый ряд моментов, которые могут говорить об обратном:
-В одной биодобавке может содержаться сразу несколько активных компонентов, каждый из которых является потенциально безопасным, но при этом их суммарное действие на организм человека, а также взаимодействие с другими принимаемыми человеком лекарствами никому не известно.
-В подавляющем своем большинстве люди, употребляющие биодобавки, не знают содержание входящего в их состав вещества в своем организме, что может привести к увеличению содержания этого вещества. Часто недостаток какого-либо элемента в организме гораздо более доброкачественное состояние, чем его избыток.
-Врач по составу биодобавки может только теоретически предположить результат ее взаимодействия с лекарством.
-Даже у человека, считающего себя здоровым, может иметь место какое-либо заболевание. Нет данных о влиянии подавляющего количества биодобавок на течение того или иного заболевания.
-Некоторые БАДы могут содержать плохо сочетаемые компоненты или вещества, при приеме которых возникают побочные эффекты. Кроме того, компоненты БАДов могут взаимодействовать с лекарствами, искажая их эффект.
-Длительное и бесконтрольное использование БАД повышает риск передозировки и может нанести вред здоровью.
-При одновременном приеме лекарственных препаратов и БАД может произойти как удачное их взаимодействие, так и появление различных осложнений.
-Существующее мнение о том, что БАДы содержат только натуральные вещества и поэтому они безопасны для организма, неверно. Любое растение может как лечить, так и вредить.
ПРАВИЛА ПРИМЕНЕНИЯ.
1.При употреблении БАД для профилактики различных заболеваний предпочтение следует отдавать нутрицевтикам, особенно с многосторонним влиянием на организм (витаминно-минеральные комплексы).
2.Для предупреждения дальнейшего развития уже имеющегося заболевания БАДы используют на фоне рекомендаций по питанию (диете).
3. Не следует доверять советам по использованию БАД «на собственном опыте», так как под одинаковыми симптомами могут скрываться совершенно различные заболевания. И в таких случаях прием БАДов может привести к потере времени, отягощению заболевания.В настоящее время разработаны и утверждены методы и методики лабораторных исследований содержания в БАДах того или иного вещества.
В Республике Мордовия лабораторные исследования БАД проводятся аккредитованным Испытательным Лабораторным Центром ФБУЗ «Центр гигиены и эпидемиологии в Республике Мордовия» по адресу: 430030 Саранск, ул. Дальняя, д. 1а, тел./факс (8342) 24-85-28. Центр оснащен современным оборудованием и приборами, имеет возможность исследовать широкий спектр по определению в БАДах количественного состава микроэлементов (кальций, фосфор, цинк, медь, магний) витаминов А, В1,В2, В6, Е, С, РР, Д микробиологических показателей токсичных элементов: свинца, кадмия, мышьяка, ртути пестицидов, микотоксинов. Ежегодно по обращению населения проводятся до 50-ти исследований БАД.
Важно! Прежде чем принимать биологически активные добавки, обязательно проконсультируйтесь с вашим лечащим врачом и узнайте количественное содержание того или иного вещества по результатам лабораторных исследований (испытаний).
Взаимодействие и сочетание с лекарственными препаратами
Как правильно принимать бады, если назначено несколько видов биологических добавок и фармакологические средства? При смешивании разных по составу комплексов их действие может как усилиться, так и нейтрализоваться.
Цинк и железо нельзя пить одновременно с витаминами, особенно группы B (B
3
, B
6
, B
9
, B
12
). Микроэлементы препятствуют усвоению витаминов. Промежуток между их приемом должен быть не менее 2 часов.
Кальций и магний лучше усваиваются в ночное время, когда организм отдыхает. Поэтому их пьют вечером, во время ужина или перед сном.
Жирорастворимые витамины A, D, E, K быстро усваиваются вместе с пищей. Их принимают во время еды. Нежелательно одновременно использовать лекарства на химической основе. Интервал между приемами должен составлять 1 час.
Как пить бады в комплексе с лекарственными средствами, прописывает врач. При тяжелых заболеваниях, гормональных сбоях дозировка биодобавок и медикаментов подбирается индивидуально, с учетом возраста, результатов анализов.
Несмотря на малые концентрации активных веществ в БАДах, они, тем не менее, способны усиливать или ослаблять действие лекарственных препаратов. При хронических заболеваниях следует обязательно консультироваться с лечащим врачом, показан ли вам прием той или иной биодобавки на фоне назначенной терапии.
Существуют рекомендованные нормы суточного потребления различных ингредиентов, в соответствии с которыми производители создают формулы биодобавок. Так, в странах Таможенного союза действуют следующие рекомендованные и максимальные дозировки активных веществ:
|
Ингредиент |
Рекомендованная суточная дозировка |
Максимальная суточная дозировка |
|
Белки (в том числе коллаген) |
75 г |
— |
|
Жиры ( в том числе полиненасыщенные жирные кислоты Омега-3) |
83 г 11 г |
— |
|
Углеводы ( в том числе сахар, сахароза) |
365 г 65 г |
— |
|
Пищевые волокна |
30 г |
— |
|
Кальций |
1000 мг |
2500 мг |
|
Железо |
14 мг |
40 мг – для женщин, 20 мг – для мужчин |
|
Магний |
400 мг |
800 мг |
|
Цинк |
15 мг |
25 мг |
|
Йод |
150 мкг |
300 мкг |
|
Селен |
0,07 мг |
150 мкг |
|
Витамин А |
0,8 мг |
3 мг |
|
Витамин D |
5 мкг |
15 мкг |
|
Витамин Е |
10 мг |
150 мг |
|
Витамин С |
60 мг |
900 мг |
|
Тиамин (витамин В1) |
1,4 мг |
5 мг |
|
Рибофлавин (витамин В2) |
1,6 мг |
6 мг |
|
Ниацин (витамин В3) |
18 мг |
60 мг |
|
Витамин В6 |
2 мг |
6 мг |
|
Фолиевая кислота |
0,2 мг |
0,6 мг |
|
Витамин В12 |
1 мкг |
9 мкг |
|
Биотин |
50 мкг |
150 мкг |
|
Пантотеновая кислота |
6 мг |
15 мг |
|
EPA (эйкозапентаеновая кислота) |
600 мг |
— |
|
DHA (докозагексаеновая кислота) |
700 мг |
— |
|
Сквален |
0,4 г |
1,5 г |
|
Глюкозамин |
0,7 г |
1,5 г |
|
Гиалуроновая кислота |
50 мг |
150 мг |
|
Витамин К |
120 мкг |
360 мкг |
|
Лютеин |
5 мг |
10 мг |
|
L-карнитин |
300 мг |
900 мг |
|
Коэнзим Q10 |
30 мг |
100 мг |
|
Альфа-липоевая кислота |
30 мг |
100 мг |
|
Медь |
1 мг |
3 мг |
|
Молибден |
70 мкг |
600 мкг |
|
Хром |
50 мкг |
250 мкг |
|
Марганец |
2 мг |
5 мг |
|
Кремний |
30 мг |
50 мг |
|
Ресвератрол |
30 мг |
150 мг |
|
Мангиферин |
20 мг |
50 мг |
|
Катехины |
100 мг |
300 мг |
|
Антоцианы |
50 мг |
150 мг |
|
Кофеин |
50 мг |
150 мг (в спортивном питании – 200 мг) |
|
Тригонеллин |
40 мг |
100 мг |
|
Аллицин |
4 мг |
12 мг |
|
Куркумин |
50 мг |
150 мг |
|
Фукоидан |
50 мг |
100 мг |
|
Цитруллин |
100 мг |
500 мг |
https://www.youtube.com/watch?v=F1fN4N1fZqQ
При приеме БАДов с максимальной дозировкой того или иного ингредиента особенно важно обращать внимание на список противопоказаний, который обязательно есть на стикере упаковки!
Принципы выбора гепатопротекторов в практике терапевта | #08/16 | «лечащий врач» – профессиональное медицинское издание для врачей. научные статьи.
На сегодняшний день заболевания печени широко распространены среди населения Земли. Данный факт обусловлен сохраняющимся ростом вирусных, токсических, лекарственных, аутоиммунных воздействий на орган и, что особенно актуально в последнее время, метаболических расстройств на фоне ожирения и сахарного диабета [1, 2].
В своей клинической практике врач-терапевт часто соприкасается с проблемой поражения печени у пациента как в рамках основной патологии, так и в качестве сопутствующего заболевания. При этом у больного может не быть специфических жалоб и болезнь печени диагностируется случайно при выявлении гепатомегалии и/или изменений биохимических печеночных проб.
Нередко, еще на этапе нозологической диагностики заболевания печени, таким пациентам назначаются гепатотропные препараты, часто называемые гепатопротекторами, выбор которых осуществляется, как правило, эмпирически или, в лучшем случае, с учетом синдромального подхода.
По имеющемуся определению, гепатопротекторы — это лекарственные средства, чье воздействие направлено на восстановление гомеостаза в гепатоцитах, способствующее повышению устойчивости органа к влиянию патогенных факторов, нормализации функциональной активности и стимуляции репаративно-регенераторных процессов в печени [3]. К сожалению, до настоящего времени не сформировано окончательное суждение о границах применения, эффективности и безопасности этих препаратов, что обусловлено недостаточным числом контролируемых клинических исследований (КИ), отвечающих современным принципам доказательной медицины.
В клинической практике в большинстве случаев гепатопротекторы используются:
Механизмы действия гепатопротекторов хотя отличаются большим разнообразием, однако могут быть сведены к нескольким ключевым, определяющим развитие фармакологических и клинических эффектов (табл. 1).
_575.gif)
Заметим, что единой общепринятой классификации гепатопротекторов на сегодняшний день не существует. Наиболее часто их разделяют в зависимости от происхождения, состава и механизма действия. С. В. Оковитым была предложена классификация гепатопротекторов, в нее вошли препараты, для которых гепатотропное действие является основным, преобладающим или имеющим самостоятельное клиническое значение (рис. 1) [3, 4].
_575.gif)
Применение препаратов этой группы в клинической практике крайне широко, поэтому ниже будет дана характеристика только наиболее часто используемых из них.
1. Препараты растительного происхождения
1.1. Препараты, содержащие извлечения из расторопши (Легалон, Силимар, Карсил, Гепабене), в качестве действующего вещества имеют флавоноид силимарин, представляющий собой смесь трех основных изомерных соединений: силибинина, силикристина и силидианина. Силибинин является основным компонентом не только по содержанию, но и по клиническому действию. Учитывая, что семена расторопши отличаются по накоплению основных биологически активных веществ в зависимости от условий произрастания и принадлежности к одной из хеморас (силибининовой или силидианиновой) [5], в клинике целесообразно применять только стандартизированные по силибинину препараты.
Основные КИ по силибинину проводились с использованием его лекарственной формы для внутривенного введения (дигидросукцината натриевая соль). Наиболее изучен данный препарат был при лечении хронического вирусного гепатита С (ХГС) у пациентов, не ответивших на стандартную терапию интерфероном/рибавирином. В этом случае он оказывал антицитолитический эффект и иногда позволял снизить вирусную нагрузку [6]. Однако, учитывая появление новых средств для безинтерфероновой терапии ХГС, перспективы применения препарата по этому направлению сомнительны.
При алкогольном и неалкогольном циррозе печени (ЦП) в одном исследовании внутривенное введение этого лекарственного средства также продемонстрировало увеличение выживаемости [7], тогда как в другом этот показатель не достиг статистической значимости [8].
Пероральные формы силибинина изучались при алкогольной жировой болезни печени (АЖБП), однако значимого влияния на смертность, гистологическую картину и лабораторные тесты получено не было [9, 10]. При неалкогольной жировой болезни печени (НЖБП) применение препарата в комбинации с эссенциальными фосфолипидами (ЭФЛ) и токоферолом (ВитЕ) позволило достичь уменьшения цитолиза, нормализации индекса НОМА, уменьшения выраженности стеатоза печени (по данным ультразвукового исследования (УЗИ)) [11].
Вероятно, окончательное суждение о возможностях применения силибинина при различной патологии печени можно будет сделать после проведения дополнительных КИ.
1.2. Препараты, содержащие извлечения из солодки (Фосфоглив), продемонстрировали в различных КИ антифибротическую, противовоспалительную и антистеатозную активность, в первую очередь, благодаря содержанию в них глицирризиновой кислоты (ГК).
При ХГС как внутривенное применение, так и комбинированное внутривенное и пероральное применение ГК позволяло добиться более выраженного снижения индекса гистологической активности у пациентов со 2-м и 3-м генотипом ХГС при более быстрой положительной динамике биохимических и гистологических параметров без влияния на вирусную нагрузку [12, 13]. Эти данные позволили включить Фосфоглив в национальные рекомендации по лечению ХГС в качестве адъювантного средства для пациентов, не ответивших на стандартную терапию интерфероном/рибавирином [14]. Исследования, проведенные в азиатской популяции, свидетельствуют, что длительное применение глицирризината способствовало снижению вероятности развития гепатоцеллюлярной карциномы (ГЦК) у пациентов с ХГС, особенно не отвечающих на лечение интерферонами [15].
Недавно получены данные по эффективности последовательного (в/в, затем перорально) применения глицирризин-содержащих препаратов при НЖБП и АЖБП. При НЖБП 12-недельное применение Фосфоглива позволило достичь антицитолитического эффекта и снижения индекса NAFLD fibrosis score [16]. У больных с АЖБП использование препарата в течение не менее 24 недель приводило к снижению уровня аспартатаминотрансферазы (АСТ) в крови, уменьшению индекса гистологической активности и фиброза в печени (ФП), а также поддержанию абстиненции [17, 18].
1.3. Препараты, содержащие извлечения из других растений (экстракт листьев артишока, Лив.52 и др.), широко применяются в клинической практике как гепатотропные препараты с плейотропными эффектами.
Анализ применения препаратов этой группы у пациентов с различной патологией печени и желчевыводящих путей свидетельствует об их эффективности (по влиянию на суррогатные точки терапии), в первую очередь при наличии сопутствующей моторной дискинезии желчевыводящих путей. Это обусловлено тем, что для многих растительных препаратов характерно сочетание свойств холагога (увеличение продукции желчи), холеретика (повышение текучести желчи) и холекинетика (стимулирует сократимость желчевыводящих путей). При АЖБП и НЖБП, а также при ЦП препараты не продемонстрировали высокой эффективности [19, 20].
Экстракт листьев артишока (Хофитол) обладает дополнительным детоксицирующим и диуретическим действием и может назначаться в период беременности.
2. Препараты животного происхождения (Гепатосан, Прогепар) в настоящее время используются значительно реже, чем другие гепатотропные препараты, из-за ограниченного числа КИ, позволяющих оценить их клиническую эффективность. По данным небольших исследований, Гепатосан способен ограничивать цитолиз, усиливать протеинсинтетическую способность печени [21]. Прогепар при НЖБП (60 дней лечения) может несколько уменьшать выраженность цитолиза и холестаза, повышать качество жизни и уменьшать размеры печени [22].
3. Препараты, содержащие эссенциальные фосфолипиды (ЭФЛ) (Эссенциале Н, Эссливер, Резалют Про) являются одной из наиболее часто назначаемых в России групп гепатопротекторов. Несмотря на то, что по ЭФЛ проведено огромное число КИ, различия в дизайне их проведения и качестве исследований не позволяют сделать однозначный вывод об их эффективности.
ЭФЛ обладают преимущественно антицитолитическим действием. Обязательным условием их эффективного применения является использование адекватно высоких доз (1,8 г/сут перорально или 1,0 г/сут в/в) при достаточной длительности курсов лечения [23, 24]. Следует помнить, что внутривенная форма Эссенциале Н содержит дезоксихолевую кислоту как солюбилизатор (115 мг/5 мл), поэтому парентеральное применение препарата больше 2–4 недель нежелательно. В некоторых исследованиях показано негативное влияние парентеральных форм данных гепатопротекторов на синдром холестаза. В связи с этим авторами рекомендуется взвешенное отношение к применению ЭФЛ.
Обнадеживающие данные по применению ЭФЛ получены при НЖБП. Показано, что прием препарата в дозе 1,8 г/сут 24 недели, затем 900 мг в течение 48 недель дает удовлетворительный клинический ответ у 81% пациентов, способствует снижению цитолиза, выраженности стеатоза и фиброза у 29,2% больных. Однако прекращение лечения приводит к рецидиву заболевания [24, 25].
Клинические исследования ЭФЛ при АЖБП с длительным приемом (2 года) не показали их влияния на процессы фиброзирования в печени, хотя благоприятное влияние на уровни трансаминаз и билирубина сохранялось [26, 27].
4. Препараты с преимущественным детоксицирующим действием не являются классическими гепатопротекторами, но обладают способностью уменьшать токсемию, связанную с ПКН, за счет снижения образования или увеличения утилизации эндогенных токсикантов.
4.1. Препараты с прямым детоксицирующим действием (Орнитин-аспартат, Глутамин-аргинин) усиливают метаболизм аммиака в печени и головном мозге и тем самым уменьшают проявления печеночной энцефалопатии (ПЭ). Эффективность различных лекарственных форм орнитин-аспартата при ПЭ зависит от тяжести состояния больного и составляет от 40% при тяжелой энцефалопатии до 70–90% при легкой [28]. Собственно гепатопротекторное действие препарата (антицитолитический и антихолестатический эффекты, нормализация белковосинтетической функции печени) уступает по выраженности детоксикационному эффекту.
4.2. Препараты с непрямым детоксицирующим действием уменьшают образование эндогенных токсинов (лактулоза, лактитол), активируют образование метаболитов, оказывающих детоксицирующее действие (адеметионин, Ремаксол) или ускоряют метаболизм токсикантов (метадоксин, фенобарбитал).
Лактулоза и лактитол, оказывая гипоаммониемическое действие за счет подавления образования аммиака кишечными бактериями, нашли свое применение у больных с ПЭ. При их использовании снижение концентрации аммиака в крови достигает 25–50%, что сопровождается уменьшением выраженности ПЭ, улучшением психического состояния и нормализацией электроэнцефалограммы примерно у 60–70% больных.
Адеметионин (SAM) также является одним из наиболее часто применяемых гепатопротекторов, благодаря наличию у него детоксицирующего, антихолестатического, умеренного холеретического (холагога) и антидепрессивного действия. По антихолестатическому и антицитолитическому эффекту препарат уступает урсодезоксихолевой кислоте (УДХК), хотя может уменьшать зуд с такой же эффективностью, как и УДХК.
В нашей стране применение препарата одобрено при ХГС в качестве препарата с антидепрессивным действием при комбинированной интерферон/рибавириновой терапии. Кроме того, он представляет интерес как средство базисной терапии при лекарственных поражениях печени.
Наибольшую эффективность адеметионин продемонстрировал при алкогольном ЦП (класс А-В по классификации Чайлда-Пью), позволив добиться снижения комбинированного показателя по смертности и частоте трансплантации печени за 2 года (16% vs 30%) [29]. При НЖБП эффективность препарата оказалась не так высока, как ожидалось [30–33, 55].
Ремаксол — инфузионный гепатотропный препарат, сочетающий свойства сукцинатсодержащего корректора митохондриальной дисфункции и сбалансированного полиионного раствора (в состав которого дополнительно введены метионин, инозин и никотинамид). Наиболее заметное действие он оказывает на проявления токсемии, а также цитолиза и холестаза, что позволяет его использовать в качестве универсального гепатотропного препарата при различных поражениях печени как в лечебных, так и в лечебно-профилактических схемах. Его эффективность установлена при ХГС, лекарственных (противотуберкулезными агентами) и токсических (этанолом) поражениях печени [34, 35]. Подобно экзогенно вводимому SAM, Ремаксол обладает мягким антидепрессивным и антиастеническим эффектом.
Метадоксин (Метадоксил) обладает направленным спектром действия, оказывая эффект при алкогольных поражениях печени за счет ускорения метаболизма и выведения продуктов распада алкоголя. При АЖБП применение метадоксина (перорально 1500 мг/сут) приводило к небольшому, но достоверному антицитолитическому и антихолестатическому эффектам, уменьшению выраженности жировой инфильтрации печени (по данным УЗИ) [36]. Обнадеживающие результаты метадоксин показал при лечении алкогольных гепатитов [37].
Фенобарбитал используется преимущественно при функциональных гипербилирубинемиях в качестве индуктора ферментов микросомального окисления в печени.
5. Препараты желчных кислот (урсодезоксихолевая кислота (УДХК), обетихолевая кислота) в настоящее время выделены в отдельную группу гепатопротекторов, благодаря их широкому спектру действия и наличию важных плейотропных эффектов. У этих препаратов описаны цитопротективное, антиапоптотическое, антихолестатическое, холеретическое, антифибротическое, иммуномодулирующее, литолитическое действие. УДХК является единственным препаратом, показавшим эффективность при тяжелых холестатических заболеваниях печени (первичный билиарный цирроз, первичный склерозирующий холангит) [38, 39]. В собственных исследованиях мы использовали препарат Урдокса, представляющий собой качественный препарат УДХК с биэквивалентностью, адекватной оригинальному препарату.
При НЖБП применение УДХК (а) снижает выраженность цитолиза и холестаза, уменьшает степень стеатоза (по данным гистологического исследования в некоторых КИ). При этом достичь такого результата удалось не во всех исследованиях, что не позволяет однозначно рекомендовать препарат при этой патологии [40]. УДХК (Урдокса) также рекомендуется в качестве терапии сопровождения при профилактике и лечении поражений печени на фоне терапии статинами [41].
Большие надежды возлагаются на селективный агонист фарнезоидных (FXR) рецепторов с антихолестатическими и гепатопротективными свойствами — обетихолевую кислоту, показавшую лучшие результаты в лечении больных с НЖБП и сахарным диабетом второго типа [42].
6. Препараты разных групп (тиоктовая (альфа-липоевая) кислота, Тиотриазолин) пока не имеют достаточной доказательной базы в КИ для того, чтобы сформировать мнение об их эффективности и безопасности при различной патологии печени.
Завершая краткую характеристику отдельных групп и препаратов, следует подчеркнуть, что для них характерны различные механизмы действия и фармакологические эффекты, что накладывает отпечаток на их влияние на основные клинико-биохимические синдромы поражения печени (табл. 2).
_575.gif)
Обращает на себя внимание, что большинство гепатопротекторов обладает множественными эффектами, что дает возможность их назначения при сочетании клинико-морфологических синдромов поражения печени. К лекарственным средствам с наиболее широким спектром доказанного действия относятся Фосфоглив, УДХК, адеметионин и Ремаксол.
Учитывая, что гепатопротекторы обладают зачастую одновременно несколькими фармакологическими эффектами, у практикующих специалистов нередко возникают вопросы, ответы на которые являются принципиальными при выборе терапии:
1) В каких клинических ситуациях обязательно должны применяться гепатопротекторы?
2) Что представляют собой по составу конкретные гепатопротекторы, какова их доказанная эффективность и безопасность при поражениях печени различной этиологии?
3) Как сориентироваться в имеющемся арсенале данных лекарственных средств, а также их дженериках и каковы наиболее оптимальные схемы их применения?
4) Существуют ли универсальные гепатопротекторы?
5) Какой препарат можно безопасно назначить пациенту с полиморбидным фоном?
6) Надо ли назначать гепатопротекторы с различными механизмами действия одновременно и какие комбинации данных средств целесообразны?
7) Какова этапность лечения гепатопротекторами и какова длительность их применения?
Чтобы ответить на все эти вопросы, прежде всего следует определиться в приоритетности терапии заболеваний печени в целом.
Как известно, феноменология болезней печени включает последовательные этапы прогрессирования в зависимости от стадии фиброзных изменений и, что важно, вне прямой связи с этиологией.
Т. е. все варианты хронических поражений печени развиваются по «универсальным» стадиям, проходя в начале этапы повреждения, далее различных стадий ФП и последующего ЦП (рис. 2).
.gif)
Таким образом, общая цель при лечении всех заболеваний печени — предотвратить развитие и прогрессирование фиброгенеза, в том числе и на этапе ЦП, так как на этой стадии значимо возрастают риски трансформации в ГЦК.
Соответствующими точками приложения гепатопротекторов при этом являются как отдельные синдромы поражения органа в виде жирового гепатоза (ЖГ), воспаления (гепатита), нарушения оттока желчи (холестаза), так и базисные процессы в виде торможения прогрессирования ФП и ЦП, с последующим снижением риска формирования ГЦК.
Принципиальной точкой зрения авторов является определение этапного подхода гепатопротективной терапии с формированием приоритетности выбора конкретного лекарственного средства в зависимости от стадии хронического заболевания печени.
Исходя из этого можно выделить следующие этапы гепатопротективной терапии:
I. Инициальный этап — направлен на экстренное «протезирование» метаболических процессов печени и купирование основных клинико-биохимических синдромов (см. табл. 2). Во время этого этапа осуществляются коррекция митохондриальной дисфункции и системы эндогенной детоксикации, восстановление мембран гепатоцитов, подавление ПОЛ, разрешение холестаза и ПКН. Данный этап служит подготовкой к базисной терапии заболевания печени и может продолжаться примерно от 2 до 8 и более недель.
II. Базисный этап — предусматривает прежде всего профилактику развития и лечение ФП и ЦП.
III. Поддерживающий этап — определен основным патогенетическим синдромом, не купированным на предыдущих этапах, и ассоциированными клиническими состояниями (АКС). Примерами АКС могут служить эндотелиальная дисфункция (ЭД) и дислипидемия при НЖБП, иммунопатологический синдром при вирусных гепатитах, депрессивные расстройства при любых заболеваниях печени. Цель данного этапа — селективное «протезирование» не восстановившихся метаболических функций гепатоцитов. Данный этап проводится пролонгированно (иногда неопределенно долго) или по требованию.
Исходя из концепции ФП как базового процесса прогрессирования всех хронических поражений печени, при выборе приоритетных направлений на первом, инициальном, этапе терапии все основные клинико-биохимические синдромы следует рассмотреть с точки зрения их влияния на фиброгенез.
Как известно, наиболее значимым, независимым фактором прогрессирования ФП, кроме синдрома цитолиза, является внутрипеченочный холестаз. При этом большинство имеющихся шкал прогноза пациентов с ЦП (Мэддрей, МЭЛД, Глазго) для оценки риска декомпенсации включают показатели холестаза.
Т. е. все заболевания печени, сопровождаемые внутрипеченочным холестазом (гепатиты вирусной, алкогольной, лекарственной, аутоиммунной этиологии, первичные билиарный цирроз и склерозирующий холангит), требуют особого внимания, поскольку именно холестаз является крайне неблагоприятным прогностическим фактором, приводящим к быстрому развитию ФП, а иногда и ЦП уже через 3–5 лет при отсутствии его лечения. На фоне холестаза в печени возникает повреждение мембран митохондрий, микротрубочек, каналикул, активация гидролаз, некроз гепатоцитов, происходит ингибирование регенерации, cтимуляция апоптоза гепатоцитов и их иммунное повреждение за счет активации экспрессии антигенов класса II HLA [43].
Поэтому гепатопротекторами для первого этапа, при наличии внутрипеченочного холестаза, являются лекарственные средства, имеющие доказанную эффективность при этом синдроме, а именно УДХК (Урдокса), адеметионин и Ремаксол. Причем в случае внутриклеточного холестаза могут применяться все три препарата как средства, улучшающие функционирование транспортных систем желчных кислот на уровне микротрубочек гепатоцитов. При дуктулярном холестазе наиболее предпочтительно применение УДХК (Урдокса). По сути, она является единственным лекарственным средством, устраняющим любые виды внутрипеченочного холестаза, за счет активации кальцийзависимой альфа-протеинкиназы, стимуляции экзоцитоза в гепатоцитах и индукции холереза, богатого бикарбонатами, что приводит к увеличению пассажа желчи и выведению токсичных желчных кислот через кишечник.
Для второго, базисного, этапа наиболее перспективным гепатопротектором, обладающим прямым антифибротическим и антипролиферативным действием, на сегодняшний день представляется Фосфоглив. Благодаря содержанию в нем оптимальной комбинации основного антифибротического агента — ГК и антицитолитической составляющей — фосфатидилхолина.
Препарат эффективен в том числе и при вирусных поражениях печени. Так, в японской популяции было показано, что развитие ЦП у больных ХГС в течение 13 лет на фоне применения глицирризина (178 пациентов) по сравнению с контрольной группой (100 человек) составило 28% и 40% соответственно (р < 0,002), а возникновение ГЦК в течение 15 лет на фоне применения глицирризина (84 пациента) в сравнении с контролем (109 пациентов) наблюдалось у 13% и 25% человек соответственно (р < 0,002). Эти эффекты связаны со способностью ГК подавлять активность звездчатых клеток печени, угнетая синтез коллагена I и III типов [44, 45].
Выбор лекарственного препарата на третьем, поддерживающем, этапе определяется ведущим клинико-лабораторным синдромом.
В зависимости от этиологии и характера поражения печени, инициальный и поддерживающий этапы имеют свои особенности, тогда как базисный этап во всех случаях предусматривает профилактику и лечение ФП (табл. 3).
_575.gif)
Вирусные гепатиты В и С остаются важнейшей зоной применения гепатопротекторов. При этом противовирусная терапия, несмотря на ее «прорыв» в отношении эффективности элиминации вируса, тем не менее, может быть использована не более чем у 50–70% пациентов ввиду наличия к ней противопоказаний, достаточно высокой стоимости, плохой переносимости. Кроме того, необходимо учесть, что ее назначение сопровождается расходом основного внутриклеточного детоксиканта — глутатиона, нарушением синтеза белков переносчиков и транспорта жиров, с возможным последующим расстройством транспорта желчных кислот. В этой связи основными точками приложения гепатопротекторов при вирусных гепатитах являются:
1) подготовка к противовирусной терапии (уменьшение цитолиза, разрешение желтухи (холестаза), создание запасов глутатиона);
2) преодоление побочных эффектов противовирусной терапии (купирование цитолиза, холестаза, восстановление запасов глутатиона);
3) предупреждение развития фиброза — главная цель терапии гепатопротекторами, в том числе после завершения успешной противовирусной терапии;
4) синдромальная терапия при невозможности элиминации этиологического фактора (коррекция цитолиза, холестаза, иммунного воспаления и ПКН).
Основными средствами, восстанавливающими запасы глутатиона, являются адеметионин и Ремаксол. Для купирования явлений холестаза применяют УДХК (Урдокса) и адеметионин, как упоминалось выше. В качестве эффективного антифибротического препарата у пациентов с вирусными гепатитами используют Фосфоглив.
Отдельного рассмотрения в отношении применения гепатопротекторов требует НЖБП, которая в популяции достигает 23–58%, а у лиц с избыточной массой тела — до 74–98%. Заболевание имеет определенную последовательность стадий: ЖГ, неалкогольный стеатогепатит (НАСГ), ФП и ЦП. При этом ФП может формироваться еще на этапе ЖГ, вследствие апоптоза перегруженных липидами гепатоцитов. Как свидетельствуют результаты метаанализа 2021 г., ФП является самым значимым прогностическим фактором течения НЖБП, приводящим не только к развитию криптогенного ЦП, но и к повышению рисков сердечно-сосудистых катастроф в 3 и более раз [46–48]. Это связано с тем фактом, что ФП способствует формированию синусоидальной портальной гипертензии и по существу является эквивалентом, отражающим выраженность ЭД [49, 50].
Необходимо отметить, что в отношении лечения ЖГ в настоящее время убедительной доказательной базы по использованию гепатопротекторов не существует. Однако их назначение можно считать обоснованным в рамках адъювантной терапии АКС.
Одной из первоочередных целей патогенетической терапии НЖБП является подбор лекарственных средств, способствующих нормализации функционирования эндотелиоцитов (прямо или опосредованно) при различных проявлениях синдрома инсулинорезистентности. Описано позитивное влияние на ЭД препаратов УДХК. При оценке полугодовой терапии группы НАСГ препаратом УДХК (Урдокса) в дозе 17 мг/кг массы тела 3 раза с день в течение 6 месяцев было выявлено достоверное увеличение диаметра плечевой артерии (р < 0,005), что является проявлением вазодилатирующего действия препаратов, а также улучшение дилатирующей функции сосудов за счет показателей эндотелий-зависимой вазодилатации [18].
Отдельным показанием для терапии у больных НЖБП, в том числе с ЖГ, является применение препаратов с антифибротическим действием [51–53]. Фосфоглив, один из немногих гепатопротекторов, который позволяет значимо влиять на проблему ФП у больных НЖБП.
Особого внимания заслуживает АЖБП, распространенность которой в российской популяции продолжает оставаться на высоком уровне. Прогноз при этом заболевании определяется прежде всего риском летального исхода от острого алкогольного стеатогепатита, который может манифестировать на любой стадии АЖБП — как на этапе ЖГ, так и при ФП или ЦП. При этом риск летальности зависит от выраженности холестаза, ПКН, стадии фиброзных изменений в печени и наличия АКС (патология сердечно-сосудистой, нервной, эндокринной систем, почек). Поэтому главной задачей в лечении АЖБП является профилактика летального исхода, прогрессирования ФП и коррекция АКС. Препаратами выбора среди гепатопротекторов в данном случае являются средства, которые эффективны для коррекции синдромов холестаза, цитолиза и ПКН. Наиболее часто применяются адеметионин, Ремаксол, Метадоксил, УДХК (Урдокса), ЭФЛ (при отсутствии холестаза). В качестве базисной терапии, направленной на предотвращение прогрессирования ФП, также как и при других хронических заболеваниях печени, применяется Фосфоглив [54].
Исходя из принципа этапности, в качестве практического применения предлагается схема гепатопротективной терапии при различных этиопатогенетических формах поражения печени (табл. 4).
_575.gif)
В заключение ответим на поставленные выше вопросы:
- Гепатопротекторы обязательно должны применяться во всех клинических ситуациях, сопровождаемых признаками повреждения печени (биохимические печеночные синдромы, ФП и ЦП), как при основной патологии органа, так и в целях «прикрытия», в случаях применения препаратов с потенциальным гепатотоксическим действием.
- Существует большой арсенал гепатопротекторов, различающихся по составу и механизмам действия, применение которых должно быть дифференцированным, в зависимости от ведущего клинико-биохимического синдрома и наличия ФП. При этом, с точки зрения влияния на основной патологический процесс, выбор гепатопротектора определяется наличием у него доказательной базы, сформированной на основании имеющихся качественных КИ.
- Наиболее целесообразным является использование оригинальных гепатопротекторов, а в случае применения дженериков следует ориентироваться на исследования, подтверждающие их фармацевтическую, биологическую и терапевтическую эквивалентность.
- Универсальных гепатопротекторов не существует. В качестве препаратов выбора следует рассматривать средства с плейотропным механизмом действия и замедляющие процессы фиброгенеза в печени. Согласно рандомизированным КИ, наиболее полно отвечают этим требованиям Фосфоглив, УДХК и адеметионин.
- Пациенту с заболеванием печени и полиморбидным фоном наиболее целесообразно назначать гепатопротекторы с наличием доказательной базы в отношении их безопасности (УДХК, Фосфоглив, адеметионин, Ремаксол).
- Гепатопротекторы с различным механизмом действия можно, а в ряде случаев, при сочетании синдромов поражений и ФП, необходимо назначать одновременно. Наиболее оптимальными комбинациями могут являться: УДХК Фосфоглив; УДХК адеметионин Фосфоглив; Ремаксол УДХК Фосфоглив; Фосфоглив Метадоксил.
- Этапность применения гепатопротекторов подразумевает наличие инициального (до 1–2 месяцев), базисного (6–12 месяцев или неопределенно долго) и поддерживающего этапов (от 1 до 3 месяцев или по требованию).
В целом предложенный подход этапного применения гепатопротекторов, основанный на собственном клиническом опыте, данных доказательной медицины и знаниях об универсальной этапности течения хронических заболеваний печени, дает реальную возможность повысить эффективность их лечения, особенно в отношении прогрессирования фиброзных изменений органа, трансформации патологического процесса в ЦП и ГЦК, а также предупреждения связанных с ФП ассоциированных состояний.
Литература
- Olson J. C. Acute-on-chronic and decompensated chronic liver failure: definitions, epidemiology and prognostication // Crit Care Clin. 2021. Vol. 32, № 3. P. 301–309.
- Sayiner M., Koenig A., Henry L., Younossi Z. M. Epidemiology of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis in the United States and the rest of the world // Clin Liver Dis. 2021. Vol. 20, № 2. P. 205–214.
- Оковитый С. В., Безбородкина Н. Н., Улейчик С. Г., Шуленин С. Н. Гепатопротекторы. М.: ГЭОТАР-Медиа, 2021. 112 с.
- Оковитый С. В., Суханов Д. С., Романцов М. Г. Гепатотропные средства: современное состояние проблемы // Терапевтический архив. 2021. Т. 84, № 2. С. 62–68.
- Щекатихина А. С. Гепатопротекторные свойства флаволигнанов // Труды Белорусского Государственного Университета. 2009. Т. 4, № 1. С. 27–48.
- Yang Z., Zhuang L., Lu Y. et al. Effects and tolerance of silymarin (milk thistle) in chronic hepatitis C virus infection patients: a meta-analysis of randomized controlled trials // Biomed Res Int. 2021. 2021:941085.
- Ferenci P., Dragosics B., Dittrich H. et al. Randomized controlled trial of silymarin treatment in patients with cirrhosis of the liver // J Hepatol. 1989. Vol. 9, № 1. P. 105–113.
- Pares A., Planas R., Torres M. et al. Effects of silymarin in alcoholic patients with cirrhosis of the liver: results of a controlled, double-blind, randomized and multicenter trial // J Hepatol. 1998. Vol. 28, № 4. P. 615–621.
- Bunout D., Hirsch S., Petermann M. et al. Controlled study of the effect of silymarin on alcoholic liver disease // Rev Med Chil. 1992. Vol. 120, № 12. P. 1370–1375.
- Trinchet J. C., Coste T., Lévy V. G. et al. Treatment of alcoholic hepatitis with silymarin. A double-blind comparative study in 116 patients // Gastroenterol Clin Biol. 1989. Vol. 13, № 2. P. 120–124.
- Loguercio С., Andreone P., Brisc C. et al. Silybin combined with phosphatidylcholine and vitamin E in patients with nonalcoholic fatty liver disease: a randomized controlled trial // Free Radical Biology & Medicine. 2021. Vol. 52, №. P. 1658–1665.
- Ивашкин В. Т., Маевская М. В., Богомолов П. О. и др. Результаты открытого сравнительного рандомизированного исследования ОРИОН: оценка эффективности отечественных препаратов Альтевир и Фосфоглив в комбинированной терапии больных хроническим гепатитом С // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2021. Т. 22, № 6. С. 27–37.
- Manns M. P., Wedemeyer H., Singer A. et al. Glycyrrhizin in patients who failed previous interferon alpha-based therapies: biochemical and histological effects after 52 weeks // J Viral Hepat. 2021. Vol. 19, № 8. P. 537–546.
- Ивашкин В. Т., Ющук Н. Д., Кожевникова Г. М. и др. Рекомендации по диагностике и лечению взрослых больных гепатитом С // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2021. Т. 23, № 2. С. 41–70.
- Ikeda K. Glycyrrhizin injection therapy prevents hepatocellular carcinogenesis in patients with interferon- resistant active chronic hepatitis C // Hepatol Res. 2007. Vol. 37, Suppl 2. P. S287-S293.
- Недогода С. В., Чумачек Е. В., Санина М. С., Почепцов Д. А. Препарат «Фосфоглив» в терапии неалкогольной жировой болезни печени: предварительные результаты многоцентрового рандомизированного двойного слепого плацебоконтролируемого исследования «ГЕПАРД» (PHG-M2/P02–12) // Клинические перспективы гастроэнтерологии, гепатологии. 2021. № 5. С. 16–22.
- Винникова М. А., Усманова Н. Н., Ненастьева А. Ю., Пинская Н. В. Эффективность и безопасность препарата «Фосфоглив» при алкогольной болезни печени: предварительные результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования «ЯГУАР» (PHG-M2/P03–12) // Клинические перспективы гастроэнтерологии, гепатологии. 2021. № 4. С. 23–28.
- Мехтиев С. Н., Зиновьева Е. Н. Соколовский С. В. Эндотелиальная дисфункция как фактор прогрессирования неалкогольного стеатогепатита. Терапевтические подходы // Эффективная фармакотерапия. 2021. № 2. С. 36–44.
- De Silva H. A., Saparamadu P. A., Thabrew M. I. et al. Liv. 52 in alcoholic liver disease: a prospective, controlled trial // J Ethnopharmacol. 2003. Vol. 84, № 1. P. 47–50.
- Fleig W. W., Morgan M. Y., Holzer M. A. The ayurvedic drug Liv. 52 in patients with alcoholic cirrhosis. Results of a prospective, randomised, double-blind, placebo-controlled clinical trial // J hepatol. 1997. Vol. 26, Suppl. 1. Р. 127.
- Иванченкова Р. А., Гаценко В. П., Атькова Е. Р. Энтеросан и Гепатосан в лечении диспепсии при хронических заболеваниях желчевыводящих путей // Поликлиника. 2009. № 2. С. 48–50.
- Громова О. А. Комплексный гепатопротекор прогепар: опыт клинического использования // Профилактическая медицина. 2021. Т. 15, № 6. С. 61–63.
- Gundermann K. J., Kuenker A., Kuntz E., Drozdzik M. Activity of essential phospholipids (EPL) from soybean in liver diseases // Pharmacol Rep. 2021. Vol. 63, № 3. P. 643–659.
- Gundermann K. J., Gundermann S., Drozdzik M., Mohan Prasad V. G. Essential phospholipids in fatty liver: a scientific update // Clin Exp Gastroenterol. 2021. Vol. 63, № 9. P. 105–117.
- Dajani A. I., Abu Hammour A. M. A., Zakaria M. A. et al. Essential phospholipids as a supportive adjunct in the management of patients with NAFLD // Arab J Gastroenterol. 2021. Vol. 16, № 3–4. P. 99–104.
- Lieber C. S., Weiss D. G., Groszmann R. et al. I. Veterans Affairs Cooperative Study of polyenylphosphatidylcholine in alcoholic liver disease: effects ondrinking behavior by nurse/physician teams // Alcohol Clin Exp Res. 2003. Vol. 27, № 11. P. 1757–1764.
- Lieber C. S., Weiss D. G., Groszmann R. et al. II. Veterans Affairs Cooperative Study of polyenylphosphatidylcholine in alcoholic liver disease // Alcohol Clin Exp Res. 2003. Vol. 27, № 11. P. 1765–1772.
- Pérez Hernández J. L., Higuera de la Tijera F., Serralde-Zúñiga A. E., Abdo Francis J. M. Critical analysis of studies evaluating the efficacy of infusion of L-ornithine L-aspartate in clinical hepaticencephalopathy in patients with liver failure // Ann Hepatol. 2021. Vol. 10, Suppl. 2. P. S66-S69.
- Mato J. M., Cámara J., Fernández de Paz J., Caballería L. et al. S-adenosylmethionine in alcoholic liver cirrhosis: a randomized, placebo-controlled, double-blind, multicenter clinical trial // J Hepatol. 1999. Vol. 30, № 6. P. 1081–1089.
- Барановский А. Ю., Райхельсон К. Л., Марченко Н. В. Применение Гептрала в терапии неалкогольного стеатогепатита // Здоров`я Украiни. 2021. № 23. С. 42–43.
- Martínez-Uña M., Varela-Rey M., Mestre D. et al. S-Adenosylmethionine increases circulating very-low density lipoprotein clearance in non-alcoholic fatty liver disease // J Hepatol. 2021. Vol. 62, № 3. P. 673–681.
- Medici V., Virata M. C., Peerson J. M. et al. S-adenosyl-L-methionine treatment for alcoholic liver disease: a double-blinded, randomized, placebo-controlled trial // Alcohol Clin Exp Res. 2021. Vol. 35, № 11. P. 1960–1965.
- Virukalpattigopalratnam M. P., Singh T., Ravishankar A. C. Heptral (ademetionine) in patients with intrahepatic cholestasis in chronic liver disease due to non-alcoholic liver disease: results of a multicentre observational study in India // J Indian Med Assoc. 2021. Vol. 111, № 12. P. 856–859.
- Ильченко Л. Ю., Оковитый С. В. Ремаксол: механизм действия и применение в клинической практике. Часть 1. // Архивъ внутренней медицины. 2021. Т. 6, № 2. С. 16–21.
- Ильченко Л. Ю., Оковитый С. В. Ремаксол: механизм действия и применение в клинической практике. Часть 2. // Архивъ внутренней медицины. 2021. Т. 6, № 3. С. 8–18.
- Caballería J., Parés A., Brú C. et al. Metadoxine accelerates fatty liver recovery in alcoholic patients: results of a randomized double-blind, placebo-control trial. Spanish Group for the Study of Alcoholic Fatty Liver // J Hepatol. 1998. Vol. 28, № 1. P. 54–60.
- Higuera-de la Tijera F., Servín-Caamaño A. I., Serralde-Zúñiga A. E. et al. Metadoxine improves the three- and six-month survival rates in patients with severe alcoholic hepatitis // World J Gastroenterol. 2021. Vol. 21, № 16. P. 4975–4985.
- Olsson R., Boberg K. M., de Muckadell O. S. et al. High-dose ursodeoxycholic acid in primary sclerosing cholangitis: a 5-year multicenter, randomized, controlled study // Gastroenterology. 2005. Vol. 129, № 5. P. 1464–1472.
- Parés A., Caballería L., Rodés J. Excellent long-term survival in patients with primary biliary cirrhosis and biochemical response to ursodeoxycholic acid // Gastroenterology. 2006. Vol. 130, № 3. P. 715–720.
- EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease // J Hepatol. 2021. Vol. 64, № 6. P. 1388–1402.
- Григорьева И. Н., Поздняков Ю. М. Статины и урсодезоксихолевая кислота: сотрудничество или нейтралитет? // Рациональная фармакотерапия в кардиологии. 2009. Т. 5, № 6. С. 51–54.
- Mudaliar S., Henry R. R., Sanyal A. J. et al. Efficacy and safety of the farnesoid X receptor agonist obeticholic acid in patients with type 2 diabetes and nonalcoholic fatty liver disease // Gastroenterology. 2021. Vol. 145, № 3. P. 574–582.
- Райхельсон К. Л., Прашнова М. К. Урсодезоксихолевая кислота: существующие рекомендации и перспективы парименения // Доктор. Ру. 2021. № 12. С. 50–56.
- Rino Y, Yukawa N, Yamamoto N. Does herbal medicine reduce the risk of hepatocellular carcinoma? // World J Gastroenterol. 2021. Vol. 21, № 37. P. 10598–10603.
- Tsubota A., Kumada H. Therapeutic strategies for hepatitis C // Nihon Rinsho. 2004. Vol. 62, Suppl. 7 (Pt 1). P. 441–447.
- Бабак О. Я., Колесникова Е. В. Участие печени в формировании метаболического синдрома и инсулинорезистентности. Состояние проблемы // Сучасна гастроентерологя. 2006. № 4 (30). C. 8–12.
- Драпкина О. М., Корнеева О. Н. Неалкогольная жировая болезнь печени и сердечно-сосудистый риск: влияние женского пола // Фарматека. 2021. № 15. С. 1–5.
- Hamaguchi M., Kojima T., Takeda N. et al. Nonalcoholic fatty liver disease is a novel predictor of cardiovascular disease // World J. Gastroenterol. 2007; 13 (10): 1579–1584.
- Мехтиев С. Н., Мехтиева О. А. Жировая болезнь печени как фактор изменения риска сердечно-сосудистых «катастроф» у больных артериальной гипертензией // Лечащий Врач. 2021. № 5. С. 1–6.
- Casino P., Kilcoyne C. M., Quyyumi A. A., Hoeg J. M., Panza J. A. The role of nitric oxide in endothelium-dependent vasodilatation of hypercholesterolemic patients // Circulation. 1993; 88: 2541–2547.
- Мехтиев С. Н., Мехтиева О. А., Смирнова М. Н. Фиброз печени как показание для терапии у больных хроническими гепатитами // Эффективная фармакотерапия. Гастроэнтерология. 2021. № 1. № 2. С. 22–34.
- Rockey D. C. Antifibrotic therapy in chronic liver disease // Clin. Gastroenterol. Hepatol. 2005; 3: 95–107.
- Zois C., Baltayiannis G., Karayiannis P., Tsianos E. Systematic review: hepatic fibrosis — regression with therapy // Aliment. Pharmacol. Ther. 2008; 28: 1175–1187.
- Мехтиев С. Н. Перспективы комплексной терапии больных алкогольной болезнью печени с выраженными стадиями фиброза // Эффективная фармакотерапия. 2021. № 2. С. 15–22.
- Le M. D., Enbom E., Traum P. K. et al. Alcoholic liver disease patients treated with S-adenosyl-L-methionine: an in-depth look at liver morphologic data comparing pre and post treatment liver biopsies // Exp Mol Pathol. 2021. Vol. 95, № 2. P. 187–191.
С. Н. Мехтиев*, 1, доктор медицинских наук, профессор
С. В. Оковитый**,доктор медицинских наук, профессор
О. А. Мехтиева*, кандидат медицинских наук, доцент
* ГБОУ ВПО СПбГМУ им. И. П. Павлова МЗ РФ, Санкт-Петербург
** ГБОУ ВПО Санкт-Петербургская ГХФА МЗ РФ, Санкт-Петербург
1 Контактная информация: clini-expert@mail.ru