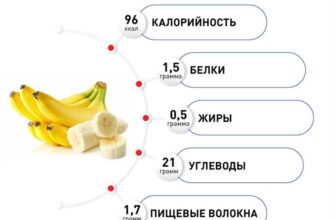
L-тироксин 50мкг n50 табл — цена 83 руб., купить в интернет аптеке в москве l-тироксин 50мкг n50 табл, инструкция по применению
Новое в диагностике и лечении аит

Эндокринология – наука ультрасовременная!! Она появилась только в 20 веке. Подходы в диагностике и лечении многих эндокринных заболеваний постоянно меняются по мере появления новых исследований о причинах, вызвавших ту или иную патологию, человек продолжает изучать гормонально-эндокринные, и не только, тайны своего организма
![]()
В ближайших темах блога я представлю:
1) новый подход в лечении АИТ
2) новый взгляд на лечение ожирения и обновлённое меню
3) новый взгляд на проблему лечения сахарного диабета 2 типа и прогрессирования осложнений. В основе теории лежит деление сахарного диабета 2 типа на подруппы по наличию аутоиммунной реакции на инсулин, что позволит спрогнозировать различные варианты течения сахарного диабета 2 типа и появление осложнений.
Но сегодня рассказ про такой загадочный аутоиммунный тиреоидит . В настоящее время в целом отмечается рост аутоиммунных заболеваний. Но именно аутоиммунные заболевания щитовидной железы стоят особняком от других иммунных патологий. Из всей тиреоидной патологии на долю АИТ приходится 20-50% случаев. Чаще болеют женщины старше 60 лет, особенно жители мегаполисов.
В клинической картине АИТ можно выделить жалобы, проебладающие в зависимости от возраста. С ними люди, как правило, и обращаются на приём к врачу:
Для молодых с АИТ характерны жалобы на выпадение волос, прибавку веса, запоры (констипация), ломкость ногтей, сухость кожи.
В среднем возрасте – преобладают жалобы на симптомы артроза и остеохондроза, депрессии, артериальной гипертонии.
за 50 лет из жалоб преобладают неврологические и сердечно-сосудистые.
АИТ (аутоимунный тиреоидит) – это иммуно-воспалительный процесс замедленного типа, выражающийся аутоагрессией иммунных клеток к собственным клеткам щитовидной железы в виде деструктивного процесса и инфильтрации ткани железы клетками воспаления: нейтрофилами, макрофагами и др. с выработкой антител к тироглобулину и микросомальным белковым структурам щитовидной железы.
Сами антитела не способны разрушать клетки и фолликулы щитовидной железы ![]() Воспаление – деструкцию (разрушение ткани) вызывают именно иммунные клетки.
Воспаление – деструкцию (разрушение ткани) вызывают именно иммунные клетки.
Теорий о причинах появления АИТ множество. Вот основные из них:
1)вирусная, это провокация воспалительного процесса вирусами Коксаки и герпеса (6 типа и др);
2)генетическая теория предпосылки к иммунным заболеваниям (так же как и бронхиальная астма, ревматоидный артрит, и др);
3) повышенное потребление йода в виде медикаментов провоцирует и усиливает активность аутоиммунного процесса в щитовидной железе. Академик РАЕН Велданова М.В. в своей монографии «Уроки тиреодологии» (базовый учебник эндокринологов по щитовидной железе ) объясняет механизмы развития этого процесса;
4) частое и бесконтрольное применение противовирусных препаратов — интерферона, циклоферона, амиксина, моноклональных антител и других, способствует развитию или обострению уже существующих аутоиммунных заболеваний, в том числе и аутоиммунного тиреоидита. На что указывает ведущий тиреоидолог в нашей стране Балаболкин М.И. в своей монографии «Фундаментальная и клиническая тиреодология».
Но, относительно недавно, появилась новая теория развития АИТ.
НОУ-ХАУ теории 2021 г (профессора, д.м.н. Рустамбековой С.А.) состоит в том, что в одну из причин развития АИТ- положена теория дисполимикр(макро)элементоза.
Дисполимикр(макро)элементоз – это нарушение гомеостатического равновесия макро-микроэлементного обеспечения организма, что также провоцирует и инициирует иммунное воспаление, оксидативный стресс и другие, повреждающие ткань щитовидной железы, патологические процессы.
Эта теория подтверждается ещё и тем, что клинические проявления (симптомы) аутоиммунного тиреоидита не характерны для истинного воспаления, встречающегося при попадании в железу инфекции.
Теория дисмикроэлемнотозов сейчас популярна и в акушерстве
(гипомагниемия, гипокальцимия), в кардиологии уже давно, при аритмии, нарушениях ритма.
Объясняю : наш организм для нормального функционирования имеет определённый набор микро(макро) элементов: макроэлементы -это калий, кальций, магний и др. Микроэлементы: селен, цинк, йод, железо и т.д.
Если вспомнить школьно-студенческие знания, то эти микро(макро)элементы есть во всех клетках организма – они участвуют во всех обменных процессах и в составе многих ферментов организма, в том числе участвующих в образовании гормонов щитовидной железы и иммунных клетках.
Избыток или нехватка некоторых микро(макро)элементов – смертельно опасны, например, гиперкалиемия (избыток калия, вследствие почечной недостаточности – вызывает жизнеугрожаемые аритмии). Другие микро(макро)элементозы не так опасны, но нарушают работу многих органов, в нашем случае – щитовидной железы.
В результате многолетних исследований, учёные Москвы пришли к выводу, что щитовидной железе для работы необходимы не только так популяризированный йод ![]() , но и селен, цинк магний, и другие, не менее важные микроэлементы.
, но и селен, цинк магний, и другие, не менее важные микроэлементы.
И очень мешают работе щитовидной железе выбрасываемые в атмосферу в результате работы промышленных предприятий, транспорта, и по другим причинам: кадмий и свинец!
Экологическая обстановка в городе или регионе, где проживает человек, как оказалось, напрямую влияет на развитие АИТ, вследствие переизбытка токсичных элементов: свинца, кадмия, алюминия, ртути и др. в воздухе, воде, почве.
Вот почему сейчас АИТ называют экологически зависимым заболеванием.
Кадмий, например, является прямым антагонистом полезных селена и цинка.
Поэтому, для построения правильной тактики лечения при АИТ, необходимо сдать микро(макро)элементный состав крови или волос, куда обязательно должны войти: йод, кальций, железо, фосфор, калий, магний, селен, цинк, медь, марганец, кадмий, свинец и ртуть. На основе этого анализа решается, как надо правильно откорректировать имеющиеся изменения. Это и есть индивидуализированный подход к лечению пациента.
Если при этом есть нарушении функции железы: гипо- или гипертиреоз – они подлежат корректировке принятыми для этого по стандарту лекарствами – Тирозол (Мерказолил) или Л-тироксин
(Эутирокс).
В монографическом исследовании дисмикроэлементозов проф. Рустамбековой С.А. показано на клинических примерах, что корректировка макро(микро)элементной дисфункции организма приводит:
— к уменьшению титра антител к ТПО и ТГ
— уменьшению воспалительного процесса
— исчезновению узлов, а вернее сказать, псевдоузлов на фоне АИТ
— более быстрой нормализации уровня ТТГ и Т4 свободного
— исчезновению симптомов, характерных для гипотиреоза, что не всегда компенсируется даже приёмом Л-тироксина
— более быстрому уменьшению одутловатости – отёчности лица, сухости кожи, слабости и других симптомов.
Но для достаточной эффективности курс лечения микро-макроэлементами не должен быть меньше 3 месяцев.
Наиболее эффективными препаратами являются:
— препараты селена (дозы первые месяцы лечения не менее 200мкг), — — препараты магния (можно без В6, при аллергии на витамины гр В) , — препараты цинка,
— препараты йода !очень строго по потребности! и др.
И этот подход оправдывает себя, а в некоторых случаях, я думаю, сможет помочь длительной ремиссии АИТ (без лечения гормонами) или излечению в его начальных стадиях заболевания.
Материал подготовлен на основе монографии С.Рустамбековой. Микроэлементозы при заболеваниях щитовидной железы, 2021 .Из-во Lap Lambert A.P. Германия.
Популярные вопросы и ответы
На типичные вопросы пациентов о гормонах щитовидной железы мы попросили ответить врача-эндокринолога Елену Жучкову.
Кому и когда нужно сдавать анализы на гормоны щитовидной железы?
Исследование гормонов щитовидной железы показано при:
- отеках или утолщении в области шеи;
- нерегулярном, ускоренном сердечном ритме, или замедлении пульса;
- высоком уровне холестерина;
- остеопорозе, особенно в молодом возрасте;
- облысении, появлении сухости кожных покровов, ломкости ногтей, выпадении и ломкости волос;
- изменении температуры тела – стабильном снижении или повышении;
- проблемах с наступлением беременности или вынашиванием ребенка, нарушениях менструального цикла;
- нарушениях сна – отсутствии сна или постоянной сонливости;
- хронической усталости, стойкого состояния общей слабости;
- возросшем аппетите;
- патологиях щитовидной железы у кровных родственников;
- у детей – при задержке умственного, полового или физического развития.
Стоит отметить, что показанием для исследования гормонов щитовидной железы служат также изменения поведения человека: появление заторможенности, малоподвижности или, напротив, суетливости, вспыльчивости, а также прогрессирующее снижение памяти, снижение фона настроения, апатия.
Сегодня анализы гормонов щитовидной железы входит в обязательное обследование кардиолога, гинеколога, дерматолога и некоторых других.
Как правило, при первичном исследовании сдается кровь на ТТГ, свободный Т4, антитела к ТПО. Показания для более расширенного обследования определяет специалист.
Как подготовиться к сдаче анализов на гормоны щитовидной железы?
К тестированию щитовидной железы на гормоны особенной подготовки не требуется. Их уровень достаточно стабилен и не зависит от приема пищи. Просьба сдать гормоны натощак связана с тем, что после употребления жирной пищи затрудняется исследование из-за «помутнения» плазмы крови. Однако это никак не влияет на его результат.
Кровь на гормоны щитовидной железы можно сдавать утром, днем и вечером, поскольку их уровень в течение суток практически не колеблется. Женщины могут проходить обследование в любой день менструального цикла.
Если Вы принимаете препарат тироксин – не отменяйте его заблаговременно. Просто откажитесь от таблетки непосредственно перед сдачей анализа и не забудьте принять препарат после сдачи крови! Предупредите врача, если вы принимаете какие-либо препараты (например, глюкокортикостероиды, добутамин, которые могут влиять на результат) и это поможет верно интерпретировать результат.
Могут ли быть неверные результаты? Что влияет на результат исследования?
На результат исследования могут повлиять заболевания, не связанные со щитовидной железой, такие как: онкологические заболевания, заболевания надпочечников, тяжелые психические заболевания, нефротический синдром (болезни почек), хронические болезни печени и некоторые другие.
Есть ли противопоказания к исследованию на гормоны щитовидной железы?
Противопоказания – физические перегрузки и употребление алкоголя накануне. Они могут повлиять на результаты. Поэтому от них нужно воздержаться за 24 часа до сдачи анализов.
Современные принципы диагностики и лечения гипотиреоза
Об актуальности проблемы гипотиреоза в клинической практике врачей абсолютно любых специальностей говорить не приходится. Гипотиреоз является одним из самых частых заболеваний эндокринной системы. По данным некоторых эпидемиологических исследований, в отдельных группах населения распространенность субклинического гипотиреоза достигает 1012% [6, 13, 16]. В последнее десятилетие появилось большое число работ, посвященных проблеме гипотиреоза, которые преобразили наши взгляды на всю патологию щитовидной железы. В первую очередь это связано с внедрением в клиническую практику современных препаратов тиреоидных гормонов. Действительно, на фоне относительно малообременительного приема этих препаратов гипотиреоз становится для пациента, по сути, не болезнью, а образом жизни, который практически не подразумевает особых ограничений. Так, гипотиреоз, по современным представлениям, перестал рассматриваться как осложнение оперативного лечения болезни Грейвса (диффузного токсического зоба) и терапии I131, фактически став их целью. Наряду с этим, гипотиреоз остается единственным неопровержимым и жизненно необходимым показанием для назначения препаратов тиреоидных гормонов.
Диагностика и скрининг гипотиреоза
Диагностика гипотиреоза, т. е. доказательство факта снижения функции щитовидной железы (ЩЖ), проста, весьма конкретна и доступна. Она подразумевает определение уровня ТТГ и Т4, при этом обнаружение изолированного повышения ТТГ свидетельствует о субклиническом гипотиреозе, а одновременное повышение уровня ТТГ и снижение уровня Т4 – о явном, или манифестном, гипотиреозе. Значительно большую проблему представляет собой определение показаний для проведения этого исследования, поскольку хорошо известно, что клиническая картина гипотиреоза крайне неспецифична: даже «явные симптомы» могут не найти подтверждения при гормональном исследовании. Наряду с этим, явный гипотиреоз, сопровождающийся значительным повышением уровня ТТГ, иногда протекает бессимптомно. Если говорить о субклиническом гипотиреозе, то он в подавляющем большинстве случаев вообще не имеет проявлений, которые бы позволили его заподозрить. Сопоставив эти факты с тем, что, по данным многих проспективных исследований, даже субклинический гипотиреоз может иметь достаточно серьезные последствия [1], возникнет закономерный вопрос о целесообразности широкого использования гормонального исследования у лиц, не предъявляющих никаких жалоб, т. е. о скрининге гипотиреоза у взрослых. Если обратиться к последним, вышедшим в 2021 г. рекомендациям по диагностики и лечению гипотиреоза Американской ассоциации клинических эндокринологов, то они не поддерживают всеобщий скрининг взрослого населения на гипотиреоз, указывая лишь на то, что он целесообразен у лиц старше 60 лет возрастная группа, в которой он чаще всего встречается [10]. Объясняется это, судя по всему, тем, что в результате скрининга преимущественно будет выявляться гипотиреоз субклинический, в отношении которого нет четких представлений о необходимости заместительной терапии. Отсюда возникает вопрос: есть ли основание активно выявлять заболевание, в отношении которого четко не разработана врачебная тактика. С другой стороны, если рассматривать все варианты нарушения функции ЩЖ, как явные, так и манифестные, включая как гипотиреоз, так и тиреотоксикоз, проведение скрининговой оценки уровня ТТГ как минимум в госпитальной выборке, т. е. среди лиц уже обратившихся за медицинской помощью, на наш взгляд, вполне оправданно, и для этого есть следующие основания:
1. Распространенность различных нарушений функции ЩЖ значительна.
2. Явный гипотиреоз и тиреотоксикоз имеют хорошо известные неблагоприятные последствия для здоровья. При этом субклинический гипотиреоз имеет тенденцию прогрессировать до манифестного, особенно у лиц с циркулирующими антителами к ЩЖ. Кроме того, субклинический гипотиреоз может быть ассоциирован с обратимой на фоне заместительной терапии гиперхолестеринемией, особенно в тех случаях, когда уровень ТТГ превышает 10 мМЕ/л; у части пациентов субклинический гипотиреоз сопровождается рядом обратимых симптомов, в т. ч. когнитивными нарушениями. Субклинический тиреотоксикоз у пожилых лиц сопровождается повышенным риском мерцания предсердий и снижения минеральной плотности костной ткани, особенно если речь идет о женщинах постменопаузального возраста.
3. Определение уровня ТТГ является точным, широко доступным, надежным и относительно недорогим тестом для диагностики любых вариантов нарушения функции ЩЖ.
4. Имеются эффективные методы лечения как гипотиреоза, так и тиреотоксикоза.
В исследовании Danese M.D. et al. [7] изучалась экономическая эффективность скрининга гипотиреоза у взрослых с учетом стоимости скринига и экономической выгоды от раннего назначения L-T4. В результате было показано, что соотношение затрат и эффективности такого скрининга значительно не отличается от стандартных, принятых в клинической медицине скрининговых процедур.
Следует заметить, что на сегодняшний день, т. е. в ситуации, когда скрининг на гипотиреоз у взрослых еще не получил распространения, определение уровня ТТГ является наиболее часто проводимым гормональным исследованием. Так, по данным рынка тест-систем для определения уровня ТТГ, в Великобритании с население 59 млн человек ежегодно производится около 9–10 млн определений уровня этого гормона [11].
Заместительная терапия
До середины ХХ в. лечение гипотиреоза подразумевало назначение пациентам экстрактов ЩЖ животных. Эти препараты, в которых практически невозможно было точно дозировать содержание тиреоидных гормонов, не могли в достаточной мере обеспечивать стойкий эутиреоз, а само их назначение сопровождалось существенными трудностями. Здесь хотелось бы сделать акцент на одном важном положении, которое, на наш взгляд, продолжает определять подходы к патологии ЩЖ в нашей стране. Дело в том, что большая часть представлений, которые сейчас многими рассматриваются как традиционные, формировались в период, когда еще не было современных препаратов левотироксина (L-T4). В этой связи в отношении любого заболевания ЩЖ, даже такого тяжелого, как рак, существовал и, к сожалению, продолжает существовать постулат (часто подсознательный) о том, что гипотиреоз является тяжелым, если не сказать фатальным, осложнением этих заболеваний (например, аутоиммунного тиреоидита) или методов их лечения (болезни Грейвса, рака, многоузлового зоба). Безусловно, такой подход был вполне оправдан в ситуации, когда в распоряжении эндокринологов был один только экстракт ЩЖ животных. Появление точно дозированных синтетических препаратов тиреоидных гормонов в корне изменило представление о лечении заболеваний ЩЖ. Тем не менее до настоящего времени приходится сталкиваться с подходами, при которых сами по себе лечебные вмешательства, направленные, по мнению их разработчиков, на предотвращение гипотиреоза (иммуносупрессоры, глюкокортикоиды и плазмаферез при АИТ) или на сохранение эутиреоза (органосохраняющие операции при раке, «экономные» резекции ЩЖ при болезни Грейвса), оказываются в сотни раз опаснее (рецидив тиреотоксикоза, метастазирование рака и т. д.), чем гипотиреоз, который на фоне приема современных препаратов L-Т4 становится для пациента, как указывалось, не заболеванием, а образом жизни [14, 15]. Современные точно дозированные синтетические препараты L-Т4 по структуре не отличаются от Т4 человека и позволяют легко и эффективно поддерживать стойкий эутиреоз на фоне их приема всего один раз в день. В ряду других эндокринных заболеваний, требующих хронической заместительной терапии (сахарный диабет 1-го типа, надпочечниковая недостаточность, дефицит гормона роста, гипопаратиреоз и др.), терапия L-Т4 при гипотиреозе справедливо считается золотым стандартом. Для этого есть несколько причин:
1. Простота диагностики гипотиреоза (в большинстве случаев достаточно одного только определения уровня ТТГ).
2. Единственной жизненно важной функцией ЩЖ является продукция тиреоидных гормонов.
3. Суточный ритм секреции у тиреоидных гормонов практически отсутствует (вариация ото дня ко дню менее 15%), в связи с чем ежедневный прием L-Т4 в одной и той же легко моделирует их эндогенную продукцию.
4. Стабильность потребности организма в тиреоидных гормонах (редкими ситуациями, в которых требуется изменение подобранной дозы L-Т4, являются выраженная динамика массы тела, беременность и параллельное назначение некоторых лекарственных препаратов).
5. Высокая биодоступность L-Т4 при пероральном приеме.
6. Длительный период полужизни L-Т4 в плазме (около 7 сут.).
7. Наличие точного критерия (уровень ТТГ), который в полной мере отражает качество компенсации гипотиреоза в течение длительного срока (около 2–3 мес.).
8. Относительная дешевизна препаратов L-Т4.
9. Качество жизни пациентов с гипотиреозом, постоянно получающих заместительную терапию L-Т4, практически не значительно отличается о такового для лиц без гипотиреоза.
Последнее положение получило подтверждение как многолетней клинической практикой, так и длительными проспективными исследованиями. Так, в популяционное исследование Peterson K. et al. [14], которое продолжалось на протяжении 12 лет (с 19681969 по 19801981 гг.), были включены 1 462 женщины среднего возраста, среди которых 29 в течение 128 лет получали заместительную терапию L-Т4 по поводу гипотиреоза. В итоге было показано, что продолжительность и качество жизни, а также риск развития основных заболеваний, определяющих эти показатели, не отличались у женщин с гипотиреозом, получавших терапию L-Т4, и в контрольной группе (n = 968).
Эти данные во многом и определяют развитие современной тиреоидологии, и через их призму необходимо смотреть на многие заболевания ЩЖ. Так, если гипотиреоз в 40–70-е гг. рассматривался как одно из осложнений лечения болезни Грейвса (операции или I131), в настоящее время большинство исследователей считают его целью лечения, поскольку риск, который несет с собой рецидив тиреотоксикоза (а тем более повторное оперативное вмешательство), несоизмерим с тем дискомфортом, который обусловлен необходимостью ежедневного приема L-T4. Именно эти данные позволили внедрить в клиническую практику во всем мире алгоритм лечения высокодифференцированного рака ЩЖ, подразумевающий полное удаление из организма тиреоидной ткани (удаление всей железы и аблативная терапия I-131).
Принципы заместительной терапии гипотиреоза хорошо известны и подробно обсуждаются во многих руководствах [3, 9]. Суммировать их можно следующим образом:
1. Для заместительной терапии гипотиреоза предпочтительны препараты L-T4.
2. Эутиреоз у взрослых обычно достигается назначением L-T4 в дозе 1,6 мкг/кг массы тела в день. Потребность в L-T4 у детей значительно выше и может достигать 4 мкг/кг в день. Начальная доза препарата и время достижения полной заместительной дозы определяются индивидуально, в зависимости от возраста, веса тела и наличия сопутствующей патологии сердца.
3. Потребность в L-T4 с возрастом снижается. Некоторые пожилые люди могут получать менее 1 мкг/кг L-T4 в день.
4. Потребность в L-T4 увеличивается во время беременности. Оценка функции ЩЖ у беременных женщин проводится не реже одного раза в 6–8 нед., при этом целевой уровень ТТГ в первом триместре составляет 0,1–2,5 мЕд/л, а во втором и третьем – 0,1–3,0 мЕд/л.
5. У женщин с гипотиреозом в постменопаузе, которым назначается заместительная терапия эстрогенами, для поддержания нормального уровня ТТГ может понадобиться увеличение дозы L-T4.
6. Целью заместительной терапии первичного гипотиреоза является поддержание уровня ТТГ в пределах нормы (0,4–4,0 мМЕ/л).
7. Целью заместительной терапии вторичного гипотиреоза является поддержание уровня Т4 крови на уровне, соответствующем верхней трети нормальных значений для этого показателя.
8. Уровень ТТГ медленно меняется после изменения дозы L-T4; его исследуют не ранее чем через 6–8 нед. после этого.
9. Пациентам, получающим подобранную дозу L-T4, рекомендуется ежегодно исследовать уровень ТТГ. На уровне ТТГ не сказывается время забора крови и интервал после приема L-T4.
10. L-T4 должен приниматься натощак в одно и тоже время суток и как минимум с интервалом в 4 ч до или после приема других препаратов или витаминов.
11. Прием таких препаратов и соединений, как холестирамин, железа сульфат, соевые белки, сукральфат и антациды, содержащие гидроокись алюминия, которые снижают абсорбцию L-T4, может потребовать увеличения его дозы.
12. Увеличение дозы L-T4 может понадобиться при приеме пациентов рифампина и антиконвульсантов, которые изменяют метаболизм гормона.
Хорошо известно, что значительно хуже выполняются рекомендации по приему сразу нескольких препаратов либо при необходимости сложного дробления таблеток. Например, при ограниченном количестве дозировок L-T4 назначение пациенту индивидуальной дозы в 75 и 125 мкг наталкивается на существенное неудобство. В США и многих странах Европы на рынке имеется до 12 дозировок L-T4. В России в настоящее время зарегистрированы 9 дозировок Эутирокса: 25, 50, 75, 88, 100, 112, 125, 137 и 150 мкг в одной таблетке, что позволяет подобрать максимально точную дозу препарата, существенно облегчает подбор терапии и обеспечивает лучшую компенсацию гипотиреоза.
Оценка адекватности заместительной терапии
Целью лечения гипотиреоза является стойкое поддержание в организме уровня тиреоидных гормонов на уровне, который удовлетворяет физиологическим потребностям. На сегодняшний день единственными клетками, реакция которых на уровень тиреоидных гормонов в организме может быть измерена количественно, т. е. объективно, являются тиротропоциты аденогипофиза. Как указано выше, целью заместительной терапии является стойкое поддержание уровня ТТГ в пределах нормы (0,4–4,0 мЕд/л). Здесь следует указать на то, что на протяжении последних 10 лет активно обсуждается вопрос о том, что более физиологичным следует считать поддержание уровня ТТГ в т. н. низконормальном диапазоне: 0,4–2,0 мЕд/л. Обсуждение этого вопроса закономерно вытекает из каждодневной клинической практики. Совершенно очевидно, что у одного и того же пациента уровень ТТГ может сохраняться в пределах нормы (0,4–4,0 мЕд/л) при назначении ему разных доз L-Т4. Какую дозу L-Т4 предпочесть, если уровень ТТГ остается нормальным как при назначении 100 мкг, так и при назначении 125 мкг в день? На 25 мкг больше или меньше? Рассуждения о т. н. низконормальном уровне ТТГ базируются на том факте, что у подавляющего большинства людей уровень ТТГ в норме как раз и составляет 0,4–2,0 мМЕ/л. Как было показано в Викгемском исследовании, уровень ТТГ более 2,0 мМЕ/л ассоциирован с повышенным риском развития гипотиреоза у носителей антител к ЩЖ [17]. Интересны результаты крупного популяционного исследования NHANES-III [8]. В него вошли 17 353 жителя США в возрасте старше 12 лет. После исключения всех лиц с тиреоидной патологией (зоб, гипотиреоз, тиреотоксикоз и др.), принимающих препараты, влияющие на функцию ЩЖ, андрогенов и эстрогенов, а также беременных женщин был сформирована референтная популяция, состоящая из 13 344 человек. В этой популяции средний уровень ТТГ составил 1,5 мМЕ/л (95%-ный доверительный интервал, 1,46–1,54 мМЕ/л). Таким образом, в норме (США – регион с нормальным йодным обеспечением) истинный средний уровень ТТГ с 95%-ной вероятностью лежит в узком интервале между 1,46 и 1,54 мМЕ/л. Тем не менее на сегодняшний день доказательств того, что поддержание уровня ТТГ в низконормальном диапазоне имеет какие-либо преимущества отсутствуют [10].
В последние 10–15 лет вновь возрос интерес к использованию при гипотиреозе комбинированной терапии препаратов L-Т4 и L-Т3, предпосылкой чему явились некоторые клинические и экспериментальные исследования [5]. Тем не менее эти работы на сегодняшний день еще не получили окончательной клинической оценки.
Ятрогенный гипотиреоз
Среди всех случаев первичного гипотиреоза не менее трети приходится на ятрогенный, развившийся после хирургических операций на ЩЖ или после терапии радиоактивным I131 [16]. Здесь хотелось бы остановиться на наиболее актуальной проблеме послеоперационном гипотиреозе в результате операций по поводу болезни Грейвса (диффузного токсического зоба).
В многочисленных исследованиях, которые изучали отдаленный катамнез пациентов, прооперированных на ЩЖ, было совершенно закономерно показано, что вероятность развития послеоперационного гипотиреоза зависит от объема оперативного вмешательства. Если в целом говорить об общих тенденциях лечения токсического зоба – как болезни Грейвса, так и многоузлового токсического, то хирургическое лечение по поводу этих заболеваний предпринимаются все реже, за исключением стран, в которых традиционно доминирует этот метод лечения, в т. ч. нашей. Основным же методом лечения токсического зоба на протяжении последних нескольких десятилетий стала терапия I131.
Прежде всего, нужно сказать о том, что болезнь Грейвса (диффузный токсический зоб) – это системное аутоиммунное заболевание, развивающееся вследствие выработки антител к рецептору тиреотропного гормона (АТ-рТТГ). Следует подчеркнуть, что при болезни Грейвса ЩЖ является мишенью (одной из мишеней) для антител, которые вырабатываются иммунной системой. В связи с этим ни оперативное лечение, ни терапия радиоактивным йодом не являются этиотропными, т. е. направленными на первопричину заболевания, а подразумевают лишь удаление из организма гиперфункционирующей ЩЖ, которое практически не оказывает влияния на течение аутоиммунного процесса. До того, как был выяснен патогенез болезни Грейвса, идеология хирургического лечения этого заболевания выглядела следующим образом: у пациента с тиреотоксикозом чаще всего выявлялось увеличение размера ЩЖ, и для того, чтобы нормализовать уровень тиреоидных гормонов, нужно удалить часть органа. Наиболее распространенной операцией была и остается в нашей стране до сих пор субтотальная резекция ЩЖ. В дальнейшем стало очевидно, что болезнь Грейвса – это системное аутоиммунное заболевание, а оставление при субтотальной резекции части ЩЖ – это оставление в организме мишени для стимулирующих антител, что приводит к рецидиву тиреотоксикоза. Поскольку удаление части железы практически не оказывает влияния на течение аутоиммунного процесса, прогнозируемых исходов у оперативного лечения болезни Грейвса может быть только два:
1. При сохранении большого тиреоидного остатка у пациента, вследствие воздействия на него стимулирующих антител, развивается рецидив тиреотоксикоза; в данном случае традиционно используется термин «рецидив», хотя, по сути дела, речь идет о продолжении заболевания.
2. При удалении всей ЩЖ или большей ее части у пациента развивается гипотиреоз, поскольку из организма удаляется мишень для антител.
В ряде случаев после частичного удаления ЩЖ, видимо вследствие спонтанной иммунологической ремиссии, какое-то время сохраняется эутиреоз. Такой исход оперативного лечения, наряду с тем, что бывает относительно редко, невозможно прогнозировать у отдельных пациентов. Таким образом, единственным одновременно благоприятным и прогнозируемым исходом и целью оперативного лечения болезни Грейвса является удаление всей ЩЖ, гарантирующее невозможность сохранения (рецидива) тиреотоксикоза. Такой подход к лечению болезни Грейвса стал принципиально возможен после того, как в клиническую практику были внедрены современные препараты L-T4 и были разработаны принципы лечения гипотиреоза, которые подробно описаны выше. По данным литературы последних лет, в большинстве зарубежных клиник операцией выбора при болезни Грейвса (золотым стандартом) стала тиреоидэктомия. Если эти операции проводятся в специализированных учреждениях, риск известных осложнений (повреждение возвратного гортанного нерва, гипопаратиреоз) не многим превышает таковой при субтотальной резекции. Так, Barakate M.S. et al. [4] провели ретроспективное исследование, в которое были включены 1 246 пациентов с болезнью Грейвса, прооперированных в интервале между 1957 и 2000 гг. За этот период у 1 246 больных была произведена субтотальная резекция ЩЖ, а у 119 – тиреоидэтомия. При анализе отдаленных последствий хирургического лечения доля стойких осложнений между двумя группами не отличалась. Авторы делают вывод о том, что субтотальная резекция ЩЖ по поводу болезни Грейвса имеет непредсказуемый результат (часто рецидив тиреотоксикоза, часто послеоперационный гипотиреоз, очень редко сохранение стойкого эутиреоза) и одинаковый риск послеоперационных осложнений с тиреоидэктомией, в связи с чем на сегодняшний день проведение субтотальных резекций ЩЖ по поводу болезни Грейвса логически (исходя из патогенеза заболевания) и практически не обосновано.
Литература
1. Левченко И.А., Фадеев. В.В. // Пробл. эндокринол. 2002. Т. 48. №2. С. 13–22.
2. Фадеев В.В., Лесникова С.В. // Пробл. эндокринол. 2003. Т. 49. №2. С. 23–31.
3. Фадеев В.В., Мельниченко Г.А. Гипотиреоз: руководство для врачей. М.: РКИ Северо пресс, 2002.
4. Barakate M.S., Agarwal G., Reeve T.S. et al. // ANZ J. Surg. 2002. Vol. 72. P. 321–324.
5. Bunevičius R., Kazanavicius G., Zalinkevicius R., Prange A.J. // N. Engl. J. Med. 1999. Vol. 340. P. 424–429.
6. Canaris G.J., Manowitz N.R., Mayor G., Ridgway E.C. // Arch. Intern. Med. 2000. Vol. 160. P. 526–534.
7. Danese M.D., Ladenson P.W., Meinert C.L., Powe N.R. // J. Clin. Endocrinol. Metab. 2000. Vol. 85. №9. P. 2993–3001.
8. Hollowell J.G., Staehling N.W., Flanders W.D. et al. // J. Clin. Endocrinol. Metab. 2002. Vol. 87. P. 489–499.
9. International thyroid testing guidelines. National academy of clinical biochemistry. Los Angeles, 2001. (http://www.nacb.org/Thyroid_LMPG.htm).
10. Garber J.R., Cobin R.H., Gharib H. et al. American Association of Clinical Endocrinologists and American Thyroid Association Taskforce on Hypothyroidism in Adults // Endocr. Pract. 2021. №18(6). P. 9881028.
11. O’Reilly D. // BMJ. 2000. Vol. 320. P. 13321334.
12. Palit T.K., Miller C.C., Miltenburg D.M. // J. Surg. Res. 2000. Vol. 90. P. 161–165.
13. Parle J.V., Franklyn J.A., Cross K.W. et al. // Br. J. Gen. Pract. 1993. Vol. 43. P. 107–109.
14. Peterson K., Bengtsson C., Lapidus L. et al. // Arch. Intern. Med. 1990. Vol. 150. P. 2077–2081.
15. Saravanan P., Chau W.F., Roberts N. et al. // Clin. Endocrinology. 2002. Vol. 57. P. 577–585.
16. Vanderpump M., Tunbridge W. // Thyroid. 2002. Vol. 12. P. 839–847.
17. Vanderpump M.P., Tunbridge W.M., French J.M. et al. // Clin. Endocrinol. 1995. Vol. 43. №1. P. 55–68.