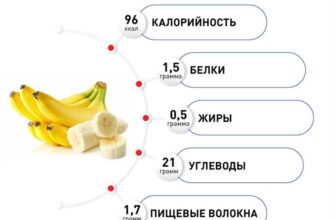
Витамины и онкология
В статье проводится обзор клинических исследований, посвящённых применению витаминных препаратов у онкологических больных, а также рассматривается их профилактическое влияние на развитие опухолевых заболеваний.
Не безызвестно, что любое онкологическое заболевание является противопоказанием к примению витаминных препаратов, и у большинства практикующих врачей сложилось мнение о пагубном их влиянии на прогрессирование онкологичнского процесса.
Тем не менее в мировой литературе накоплено небольшое число исследований, проведённых с целью изучения влияния приёма витаминов на прогноз онкологического заболевания. Среди них наиболее старой является методика высокодозовой терапии витамином С. За более чем 30-летнюю историю существования от применения высоких доз (от 10 до 65 граммов в сутки) аскорбиновой кислоты был зафиксирован лишь единый случай регрессии заболевания у больного ретикулосаркомой с метастазами в лёгкие, остальные исследования показали смешанные результаты. [1] Но в настоящее время витамин С продолжает использоваться в некоторых онкологических клиниках совместно с химиопрепаратами, и появляются данные о том, что при внутривенной инфузии аскорбиновая кислота способна вызывать оксидативный стресс путём генерации молекул перекиси водорода, селективно влияющие на опухолевые клетки поджелудочной железы. [2]
В отношении рака поджелудочной железы американскими учёными было проанализировано большое количество работ, доказывающих положительное влияния назначение витаминов А, С, D, E и К пациентам с этим заболеванием, которое выражается в усилении противоопухолевого действия химиопрепаратов. [3]
В Дании был создан целый протокол ARICA (Adjuvant Nutritional Intervention in Cancer), в соответствие с которым 32 больным раком молочной железы с наличием метастазов в подмышечных лимфоузлах в дополнение к основному (хирургическое и химиотерапия) лечению использовалось потребление витаминного коктеля, содержащего витамин С, Е, бета-каротины, селен, омега — 3ПНЖК и конэзим-Q10. В течение 18 месяцев наблюдения ни одна больная не умерла, ни у одной не выявлено признаков отдалённого метастазирования, у большинства улучшилось качество жизни в виде увеличения массы тела и снижения потребности в анальгетиках. [4]
Связь качества жизни больных онкологическим заболеваением отмечена с дефицитом витамина D [5] однако вопрос о его профилактической и лечебной эффективности в отношении онкологических заболеваний до настоящего времени остаётся нерешённым и требует дальнейшего изучения. [6]
Итого, можно сказать, что в настоящее время доказательная медицина располает крайне малым материалом, посвященному применению витаминов у онкологических больных. Но и на основании имеющегося нельзя однозначно утверждать об их абсолютном противопоказании для больных опухолевыми заболеваниями.
Куда больше накопленно всевозможной информации о влиянии приёма различных витаминных препаратов на риск развития онкологических заболеваний. Возвращаясь к витамину С, стоит отметить, что по данным одних исследований у него обнаружен профилактический эффект в отношении рака лёгкого, вплоть до установления прямой зависимости — риск рака лёгкого снижается на 7% при увеличение суточной дозы потребления аскорбата на 100 мг. [7] Но результаты крупнейшего мета-анализа 758 клинических исследований, включивших более 62 тыс. пациентов не выявил значимой связи между употреблением витамина С и риском развития онкологических заболеваний с учётом суточной дозы аскорбиновой кислоты, типа рака, пола пациента, его национальности и наличия табакокурения. [8]
Анализ 19 клинических исследований с участием более 10 тыс. пациентов с раком лёгких показал, что между приёмом витамина А и бета-каротина и риском развития рака лёгкого существует связь, однако её значения меняются в зависимости от пола пациента и ареала его обитания. [9] Так в исследовании на европейской популяции пациентов высокие дозы бета-каротинов опасны в отношении увеличения частоты рака лёгких. [10]
Другой мета-анализ с участие более 4 тыс. американских больных раком лёгкого выявил протективное влияние употребления витамина Е на риск возникновения этого заболевания. [11]
Во Франции по результатам двойного слепого плацебо-контролируемого исследования «SUpplementation en VItamines et Minéraux AntioXidants» (SU. VI. MAX) study было показано, что ежедневное потребление витамина Е в дозе 30 мг и бета-каротинов в дозе 6 мг снижает частоту онкологических заболеваний у наблюдаемых пациентов. [12]
Несмотря на это витамин Е остаётся самым противоречимым витамином, так как в отношении его есть данные, говорящие об усилении риска возникновения рака почки [13] и рака предстательной железы. [14] при его повышенном употреблении.
Витамин D можно считать наиболее изучаемым, в последние годы. Получены данные о связи дефицита этого витамина и риском развития рака простаты [15, 16] рака мочевого пузыря [17] и наиболее злокачественной формой рака молочной железы — тройной негативный рак, которые не содержит на поверхности своих клеток рецепторов ни к эстрогену, не прогестерону, ни к эпидермальному фактору роста опухоли — her2neu. [18]
Проволжаются исследования, пытающиеся выявить этиологическую составляющую в развитии определённого онкологического заболевания в дефиците того или иного нутриента. Так в британском исследование на 66 тысяч жителей было продемонстрирована важность ежедневного потребления достаточного (не менее 100 мг/сут) количества магния, как в виде добавок, так в составе мультивитаминных комплексов для первичной профилактики рака поджелудочной железы. [19]
В итальянском проспективном исследовании с участием боле 45 тысяч людей на протяжении 11 лет изучалось влияние характера питания на развитие колоректального рака. Было показано, что дополнительный приём витаминов С, Е и бета-каротинов не оказывает протективного влияния на развитие данного заболевания. [20]
В целом, проблема дефицита и наоборот повышенного потребления витаминов, как факторов риска развития онкологических заболеваний отсаётся открытой и требует дальнейшей проработки и масштабных исследований.
Литература:
1. High-Dose Vitamin C (PDQ®): Health Professional Version. (http: //www. ncbi. nlm. nih. gov/pubmed/26389504) ].
2. Cieslak J. A. , Cullen J. J. Treatment of Pancreatic Cancer with Pharmacological Ascorbate. Curr Pharm Biotechnol. 2021;16 (9): 759-70.
3. Davis-Yadley A. H. , Malafa M. P. Vitamins in Pancreatic Cancer: A Review of Underlying Mechanisms and Future Applications. Adv Nutr. 2021 Nov 13;6 (6): 774-802. doi: 10. 3945/an. 115. 009456.
4. Lockwood K. , Moesgaard S. , Hanioka T,, Folkers K. Apparent partial remission of breast cancer in ‘high risk’ patients supplemented with nutritional antioxidants, essential fatty acids and coenzyme Q10. Mol Aspects Med. 1994;15 Suppl: s231-40.
5. Martínez-Alonso M. , Dusso A. , Ariza G. , Nabal M. Vitamin D deficiency and its association with fatigue and quality of life in advanced cancer patients under palliative care: A cross-sectional study. Palliat Med. 2021 Aug 27. pii: 0269216315601954.
6. Tagliabue E. , Raimondi S. , Gandini S. Vitamin D, Cancer Risk, and Mortality. Adv Food Nutr Res. 2021;75: 1-52. doi: 10. 1016/bs. afnr. 2021. 06. 003.
7. Luo J. , Shen L. , Zheng D. Association between vitamin C intake and lung cancer: a dose-response meta-analysis. Sci Rep. 2021 Aug 22;4: 6161. doi: 10. 1038/srep06161.
8. Lee B. , Oh S. W. , Myung S. K. Efficacy of Vitamin C Supplements in Prevention of Cancer: A Meta-Analysis of Randomized Controlled Trials. Korean J Fam Med. 2021 Nov;36 (6): 278-285. Epub 2021 Nov 20.
9. Yu N. , Su X. , Wang Z. , Dai B. et. al. Association of Dietary Vitamin A and β-Carotene Intake with the Risk of Lung Cancer: A Meta-Analysis of 19 Publications. Nutrients. 2021 Nov 11;7 (11): 9309-24. doi: 10. 3390/nu7115463.
10. Malvy D. J. , Favier A. , Faure H. , Preziosi P. et. al. Effect of two years’ supplementation with natural antioxidants on vitamin and trace element status biomarkers: preliminary data of the SU. VI. MAX study. Cancer Detect Prev. 2001;25 (5): 479-85.
11. Chen G. , Wang J. , Hong X. , Chai Z. et. al. Dietary vitamin E intake could reduce the risk of lung cancer: evidence from a meta-analysis. Int J Clin Exp Med. 2021 Apr 15;8 (4): 6631-7. eCollection 2021.
12. Malvy D. J. , Favier A. , Faure H. , Preziosi P. et. al. Effect of two years’ supplementation with natural antioxidants on vitamin and trace element status biomarkers: preliminary data of the SU. VI. MAX study. Cancer Detect Prev. 2001;25 (5): 479-85.
13. Shen C. , Huang Y. , Yi S. , Fang Z. et. al. Association of Vitamin E Intake with Reduced Risk of Kidney Cancer: A Meta-Analysis of Observational Studies. Med Sci Monit. 2021 Nov 8;21: 3420-6.
14. Key T. J. , Appleby P. N. , Travis R. C. , Albanes D. Carotenoids, retinol, tocopherols, and prostate cancer risk: pooled analysis of 15 studies. Am J Clin Nutr. 2021 Nov;102 (5): 1142-57. doi: 10. 3945/ajcn. 115. 114306.
15. Trummer O. , Langsenlehner U. , Krenn-Pilko S. , Pieber T. R. et. al. Vitamin D and prostate cancer prognosis: a Mendelian randomization study. World J Urol. 2021 Jul 25.
16. Deschasaux M. , Souberbielle J. C. , Latino-Martel P. , Sutton A. et. al. A prospective study of plasma 25-hydroxyvitamin D concentration and prostate cancer risk. Br J Nutr. 2021 Nov 16: 1-10.
17. Zhang H. , Zhang H. , Wen X. , Zhang Y. et. al. Vitamin D Deficiency and Increased Risk of Bladder Carcinoma: A Meta-Analysis. Cell Physiol Biochem. 2021 Nov 9;37 (5): 1686-1692.
18. Abulkhair O. , Saadeddin A. , Makram O. , Gasmelseed A. et. al. Vitamin D Levels and Breast Cancer Characteristics: Findings in Patients from Saudi Arabia. J Steroid Biochem Mol Biol. 2021 Nov 7. pii: S0960-0760 (15) 30129-1. doi: 10. 1016/j. jsbmb. 2021. 11. 003.
19. Dibaba D. , Xun P. , Yokota K. , White E. et. al. Magnesium intake and incidence of pancreatic cancer: the VITamins and Lifestyle study. Br J Cancer. 2021 Nov 10. doi: 10. 1038/bjc. 2021. 382.
20. Vece M. M. , Agnoli C. , Grioni S. , Sieri S. et. al. Dietary Total Antioxidant Capacity and Colorectal Cancer in the Italian EPIC Cohort. PLoS One. 2021 Nov 13;10 (11): e0142995. doi: 10. 1371/journal. pone. 0142995.
Статья добавлена 5 декабря 2021 г.
Лекарственное лечение рака молочной железы
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Химиотерапия и гормонотерапия играют существенную роль в комплексном лечении рака молочной железы практически при всех стадиях заболевания. Это объясняется особенностями данной опухоли – даже на ранних стадиях заболевания велик риск существования отдаленных микрометастазов, особенно при наличии факторов риска (поражении подмышечных лимфоузлов, отрицательных рецепторах эстрадиола и прогестерона, гиперэкспрессии Неr–2/neu и т.д.). Применение адъювантной химио– и гормонотерапии значительно улучшило результаты лечения операбельного рака молочной железы. При запущенном раке молочной железы химиотерапия и гормонотерапия являются основными методами лечения, позволяющими значительно продлить жизнь больного и улучшить ее качество. У 10–25% женщин с диссеминированным раком молочной железы возможно достижение полной регрессии опухоли с длительным безрецидивным периодом.
Адъювантная терапия
Адъювантная терапия рака молочной железы сегодня представляет собой систему стандартов, эффективность которых доказана в большом числе клинических исследований [1].
До настоящего времени остается четыре независимых прогностических фактора при резектабельном раке молочной железы: поражение регионарных лимфатических узлов, размер первичной опухоли, степень дифференцировки и содержание рецепторов к стероидным гормонам (к эстрогенам – РЭ и к прогестерону – РП).
Стандартами химиотерапии и эндокринной терапии являются: 4 цикла химиотерапии в режиме АЦ (адриамицин циклофосфан) или АЦФ (адриамицин циклофосфан фторурацил) или 6 циклов химиотерапии по схеме ЦМФ (циклофосфан метотрексат фторурацил), а также тамоксифен 20 мг в день в течение 5 лет.
Первый фактор, положенный в основу назначения адъювантной терапии – поражение регионарных лимфатических узлов, разделяет всех больных на две группы.
Рак молочной железы без метастазов в регионарные лимфоузлы
Для назначения адъювантной терапии в этой группе необходимо определение групп повышенного риска. Граница для назначения адъювантной лекарственной терапии, что означает группу повышенного риска – снижение пятилетней выживаемости до 95% и менее (табл. 1).

Только в группе низкого риска пятилетняя выживаемость больных составляет более 95%. Во всех остальных группах проведение адъювантной лекарственной терапии улучшает результаты хирургического лечения.
Больным в пременопаузе с умеренным или высоким риском и положительным уровнем эстрогенных рецепторов показана химиотерапия с последующим назначением тамоксифена. При гормононезависимых опухолях показано назначение только химиотерапии.
Больным в постменопаузе с умеренным или высоким риском и положительным уровнем эстрогеновых рецепторов показан прием тамоксифена, а в группе высокого риска – комбинация химиотерапии с тамоксифеном. При отрицательном уровне рецепторов к эстрогенам показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена, а в группе высокого риска возможно дополнительное назначение химиотерапии. С уче– том возраста больных дополнительное назначение химиотерапии должно быть индивидуально обоснованным.
Рак молочной железы с метастазами в регионарные лимфоузлы
У всех больных раком молочной железы с метастазами в регионарные лимфатические узлы применение адъювантной лекарственной терапии улучшает результаты лечения.
При положительном уровне рецепторов к эстрогенам вне зависимости от менструальной функции показана комбинированная адъювантная терапия – химиотерапия и эндокринная терапия тамоксифеном.
При гормононезависимых опухолях показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена вне зависимости от уровня эстрогеновых рецепторов. Если уровень рецепторов к эстрогенам отрицательный, возможно дополнительное назначение химиотерапии. С учетом возраста больных дополнительное назначение химиотерапии должно быть индивидуальным.
При всей внешней простоте и схематичности назначения адъювантного лечения лишь методы, доказавшие свою эффективность в результате длительных клинических исследований, применяются для лечения больных. Оптимальная тактика адъювантной терапии постоянно совершенствуется. Совсем недавно химиотерапия рекомендовалась только больным в пременопаузе с метастазами в регионарные лимфатические узлы. В настоящее время только больным с низким риском и пожилым больным с положительными эстрогеновыми рецепторами не показано проведение химиотерапии.
При проведении адъювантной химиотерапии необходимо строго придерживаться оптимального режима (стандартных доз и интервалов между циклами). Неоправданные модификации режимов химиотерапии, несомненно, ухудшают результаты лечения.
Сегодня продолжаются исследования роли выключения функции яичников и рутинное применение данного метода адъювантного лечения нецелесообразно.
Появились данные об эффективности таксанов, как дополнительной химиотерапии к антрациклин–содержащим комбинациям у больных с неблагоприятным про– гнозом.
В связи с широкими исследованиями роли гиперэкспрессии рецептора Her2/neu наметились новые тенденции в оценке прогноза и лечения больных. Однако пока необходимо дополнительное число исследований для изменения практических рекомендаций.
Исследования по адъювантной терапии рака молочной железы интенсивно продолжаются, и можно надеяться, что в ближайшее время все больше и больше женщин будут излечиваться от рака молочной железы.
Неоадъювантная терапия
Неоадъювантная терапия – системное лечение, которое проводится до начала локального лечения (хирургического вмешательства или лучевой терапии).
Задачи неоадъювантной терапии:
- уменьшение размеров первичной опухоли и регионарных метастазов
- уменьшение объема оперативного вмешательства (радикальная резекция вместо радикальной мастэктомии)
- определение чувствительности опухоли к цитостатикам, выявление резистентных случаев с целью использования альтернативных режимов для адъювант– ной химиотерапии
- увеличение общей и безрецидивной выживаемости
- оценка новых режимов лечения по частоте полной клинической и морфологической ремиссии.
Стандартом неоадъювантной химиотерапии по результатам многоцентрового исследования NSABP B–18 признана схема АЦ, при применении которой объективный эффект составил 80%, полная морфологическая ремиссия отмечена у 15% больных.
Предполагалось, что раннее воздействие противоопухолевых лекарств на микрометастазы приведет к увеличению общей и безрецидивной выживаемости. Однако анализ 7 крупных рандомизированных исследований, в том числе NSABP B–18, включившего 1500 женщин с операбельным раком молочной железы, проведенный Wolff [2], не подтвердил эту гипотезу. Продолжительность жизни может быть увеличена только за счет рационального подхода к лечению – использования альтернативных режимов для адъювантной химиотерапии в случае низкой эффективности неоадъювантного лечения.
Продолжается поиск наиболее эффективного режима неоадъювантной химиотерапии. Особенно важным показателем является достижение полной морфологической регрессии опухоли, так как именно этот показатель статистически достоверно коррелирует с ростом общей выживаемости. С этой целью исследуются комбинации, включающие наиболее эффективные препараты, входящие в режимы неоадъювантной химиотерапии в последние годы – цисплатин, навельбин, таксаны. Некоторые авторы показали преимущество комбинаций антрациклинов и таксанов по сравнению со стандартным режимом АС. Разрабатываются новые режимы, включающие препараты, недавно вошедшие в практику химиотерапии, например, кселода и герцептин. Исследуются интенсивные режимы химиотерапии, однако пока не получено достоверных доказательств влияния интенсификации неоадъювантной химиотерапии на отдаленные результаты лечения.
Обсуждается количество курсов неоадъювантной химиотерапии. Признано, что эффект химиотерапии и частота полных регрессий опухоли зависят от количест– ва курсов лечения. Поэтому целесообразно проводить не менее 4 курсов, что безопасно для больных при условии регулярного контроля за динамикой заболевания.
У больных в менопаузе с положительными РЭ и/или РП применяется неоадъювантная гормонотерапия. Объективный эффект гормонотерапии достигает 50–70%. Для неоадъювантной гормонотерапии могут быть рекомендованы тамоксифен, анастразол, летрозол, экземестан.
Диссеминированный рак молочной железы
Гормонотерапия
Для выбора метода лечения перед началом терапии необходимо оценить ряд прогностических факторов, определяющих возможный ответ заболевания на проводимое лечение. Длительный период, прошедший после лечения первичной опухоли до появления отдаленных метастазов, поражение только мягких тканей и костной системы или единичные отграниченные очаги в легких, медленный рост опухоли, удовлетворительное общее состояние больной, пожилой возраст и постменопауза, положительный уровень рецептов эстрадиола и/или прогестерона свидетельствуют о вероятно высокой чувствительности опухоли к гормонотерапии. В случае раннего появления отдаленных метастазов после лечения первичной опухоли, быстрого прогрессирования заболевания, молодого возраста больной, при множественных висцеральных метастазах, наличии лимфангоита кожи или легких лечение необходимо начинать с химиотерапии.
Эффективность гормонотерапии при положительном уровне РЭ и РП достигает 50–70%, снижается при положительных рецепторах одного вида (33%). При отрицательных РЭ и РП существует небольшой процент больных (5–10%), отвечающих на гормонотерапию. Традиционными препаратами, рекомендованными для первой линии гормонотерапии у больных в менопаузе, являются антиэстрогены – тамоксифен и торемифен. В настоящее время в I линии эндокринотерапии альтернативой тамоксифену являются антиароматазные препараты – анастрозол и летрозол. Во II линии эндокринотерапии больных раком молочной железы в менопаузе (при использовании тамоксифена в I линии) в настоящее время вместо прогестинов используются антиароматазные препараты (анастрозол, летрозол, экземестан). Применять прогестины во II линии гормонотерапии считается неэтичным.
У больных в пременопаузе гормонотерапию можно начинать с выключения функции яичников с помощью агониста гонадотропин–рилизинг гормона гипофиза – гозерелина (золадекса), а также хирургическим или лучевым методами.
Эффект гормонотерапии оценивается через 6–8 нед после начала лечения. Положительным ответом считается не только полная или частичная регрессия опухоли, но и длительная стабилизация заболевания (>=6 месяцев). Лечение продолжается до прогрессирования болезни. В случае быстрого прогрессирования болезни после гормонотерапии первой линии следует начать химиотерапию. При прогрессировании после длительного положительного эффекта на фоне первой линии гормонотерапии, а также кратковременной полной или частичной регрессии опухоли начинают гормонотерапию второй линии – ингибиторы (инактиваторы) ароматазы.
Наиболее известные ингибиторы ароматазы – аминоглютетемид (ориметен, мамомит), ингибитор ароматазы первого поколения, стероидный инактиватор ароматазы – экземестан (аромазин) и препараты третьего поколения – летрозол (фемара), анастрозол (аримидекс). Экземестан, летрозол и анастрозол менее токсичны и не требуют заместительной кортикостероидной терапии. Они эффективны и у больных, принимавших ранее аминоглютетемид: если лечение аминоглютетемидом было эффективным, частота ответа составляет 25–33%, если неэффективным – 6–12%. У пременопаузальных больных ингибиторы ароматазы назначаются только после выключения функции яичников, чтобы избежать активизации синтеза эстрогенов в функционирующих яичниках по принципу «обратной связи».
Третья линия гормонотерапии – прогестины – медроксипрогестерона ацетат (фарлутал, провера) и мегестрола ацетат (мегейс). Достаточно редко в наше время в III линии гормонотерапии используются андрогены и у женщин в постменопаузе – эстрогены.
Химиотерапия
Стандартами I линии химиотерапии рака молочной железы являются схемы: ЦМФ (циклофосфан 100 мг/м2 внутрь ежедневно дни 1–14, метотрексат 40 мг/м2 в/в дни 1,8, фторурацил 600 мг/м2 в/в дни 1,8, интервал 4 нед), ЦАФ (циклофосфан 100 мг/м2 внутрь ежедневно дни 1–14, доксорубицин 30 мг/м2 в/в дни 1,8, фторурацил 500 мг/м2 в/в дни 1, 8, интервал 4 недели), АЦФ (фторура– цил 500 мг/м2, доксорубицин 50 мг/м2, циклофосфан 500 мг/м2 каждые 3 нед), ЕЦФ (фторурацил 500 мг/м2, эпирубицин 100 мг/м2, циклофосфан 500 мг/м2 каждые 3 нед), АЦ (доксорубицин 60 мг/м2, циклофосфан 600 мг/м2 каждые 3 нед).
Большинство исследователей отдают предпочтение антрациклиновым комбинациям, учитывая более высокий противоопухолевый эффект этих комбинаций по сравнению с ЦMФ. Комбинация ЦМФ чаще используется у пожилых больных, при противопоказаниях к применению антрациклинов.
Высокую эффективность показали комбинации антрациклинов и таксанов – АТ (доксорубицин 50–60 мг/м2, паклитаксел 175 мг/м2, интервал 3 нед), ЕД (эпирубицин 100 мг/м2, доцетаксел 75 мг/м2, интервал 3 нед).
Длительность химиотерапии обычно определяется ответом опухоли: после достижения максимального эффекта проводится дополнительно 2 курса ПХТ. Затем предпочтение может быть отдано наблюдению за больным до прогрессирования. При продолжении лечения до прогрессирования увеличивается время до прогресси– рования, однако общая выживаемость не меняется, при этом снижается качество жизни больных.
Ведется поиск эффективных комбинаций для первой линии лечения диссеминированного рака молочной железы, включающих новые препараты, в частности, капецитабин (кселода). Показано, что капецитабин имеет лечебную активность, сходную с ЦМФ.
У больных, имевших прогрессирование после химиотерапии антрациклинсодержащими комбинациями, стандартом дальнейшего лечения являются таксаны (паклитаксел 175 мг/м2 в/в со стандартной премедикацией 1 раз в 3 нед, доцетаксел 100 мг/м2 в/в со стандартной премедикацией 1 раз в 3 нед). В монотерапии у резистентных к антрациклинам больных объективный эффект составляет 41%. В последнее время все более популярным становится еженедельное введение таксанов, при этом увеличивается интенсивность лечения без увеличения токсичности. Эффективны комбинации таксанов с другими препаратами: навельбин 20 мг/м2 в/в дни 1, 5-й доцетаксел 75 мг/м2 в/в со стандартной премедикацией день 1-й, интервал 3 нед; паклитаксел 175 мг/м2 в/в со стандартной премедикацией день 1-й фторурацил 1 г/м2/день в/в кап. 72–часовая инфузия дни 1, 2, 3-й, интервал 3 нед; кселода 1650 мг/м2 дни 1–14 паклитаксел 175 мг/м2 (или доцетаксел 75 мг/м2)1 раз в 3 нед; гемцитабин 1 г/м2 дни 1, 15-й паклитаксел 135 мг/м2 дни 1, 15-й, интервал 4 нед.
Для третьей и последующих линий лечения четких стандартов не разработано. Применяются комбинации препаратов, включающие навельбин, препараты платины (цисплатин, оксалиплатин), антиметаболиты (длительные инфузии фторурацила, гемцитабин, томудекс, кселода). Следует отметить высокую эффективность кселоды у больных во II (объективный ответ у 36% больных) и III (20%) линиях химиотерапии. Препарат может быть рекомендован, как альтернатива таксанам во II линии химиотерапии.
Некоторые режимы, эффективные во II–III линии лечения диссеминированного рака молочной железы: МММ – митомицин 8 мг/м2 в/в день 1 митоксантрон 8 мг/м2 в/в день 1 метотрексат 30 мг/м2 в/в день 1; МЕП – митомицин 10 мг/м2 в/в день 1 цисплатин 40 мг/м2 в/в дни 2, 7 вепезид 100 мг/м2 в/в дни 3 ,4, 5, интервал 4 нед; цисплатин 80 мг/м2 в/в день 1 кселода 2000 мг/м2 внутрь ежедневно дни 1–14; навельбин 25 мг/м2 в/в дни 1, 8 митомицин 7 мг/м2 в/в день 1, интервал 4 недели; навельбин 20 мг/м2 в/в дни 1, 15 цисплатин 80 мг/м2 в/в день 1, интервал 4 нед; циклофосфан 600 мг/м2 в/в день 1 лейковорин 500 мг/м2 в/в кап. в течение 2 часов фторурацил 1,5 г/м2 в/в постоянная 24–часовая инфузия, дни 1, 15, интервал 4 нед; навельбин 25 мг/м2 в/в дни 1, 8 томудекс 1 мг/м2 в/в дни 1, 8, интервал 3 нед.
В 25–30% случаев в опухоли молочной железы отмечается гиперэкспрессия Неr–2/neu, коррелирующая с плохим прогнозом заболевания. У таких больных эф– фективен Герцептин – препарат принципиально нового механизма действия – рекомбинантные гуманизированные моноклональные антитела, связывающиеся с рецептором Неr–2/neu. Герцептин применяется еженедельно, первое введение – 4 мг/кг в/в, последующие – 2 мг/кг. Лечение продолжается до прогрессирования заболевания. Герцептин рекомендуется к применению у больных с гиперэкспрессией Неr–2/neu в комбинации с гормонотерапией и химиотерапией. Добавление герцептина к комбинации АС повысило частоту объективных эффектов с 42 до 60%. При резистентности к антрациклинам комбинация герцептина с таксолом была эффективна у 49% больных (при монотерапии таксолом эффект составил 17%). Изучаются комбинации герцептина с другими цитостатиками, например, с кселодой, навельбином [5].
Литература:
1. Материалы шестой конференции по адъювантной терапии рака молочной железы, Сан–Галлен Швейцария, 1998 год.
2. A.C.Wolff, N.E. Davidson: Primary systemic therapy in operable breast cancer. J Clin Oncol 18:1558–1569, 2000.
3. C.А. Тюляндин: Химиотерапия диссеминированного рака молочной железы. Практическая онкология, 2, 2000.
4. G.N.Hortobagyi: Options for treatment of metastatic breast cancer. ASCO 35–th Annual Meeting, May 1999.
.